高一化学第二学期期中考试
试卷(1班)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分。考试时间90分钟。
第I卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意。每小题3分,共24分)
1、某些建筑材料含有放射性元素![]() Rn(氡),会对人体产生一定危害。该原子中中子数和质子数之差是
Rn(氡),会对人体产生一定危害。该原子中中子数和质子数之差是
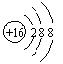 A.136
B.50
C.86 D.222
A.136
B.50
C.86 D.222
![]() 2、下列表达方式错误的是
2、下列表达方式错误的是
A、氯化氢分子的电子式: H+ [: :]- B、S2-的结构示意图:
C、O—18的原子符号:![]() D、CO2分子的结构式:O=C=O
D、CO2分子的结构式:O=C=O
3、下列物质中,既含离子键又含共价键的是
A.Na2O B.NH3 C.Ca(OH)2 D.CaBr2
4、下列燃料中,不属于化石燃料的是
 |
A.煤 B.石油 C.天然气 D.水煤气
5、下列各图中,表示正反应是吸热反应的图是
6、NO和CO都是汽车尾气里出有害物质,它们能缓慢起反应,生成氮气和二氧化碳,对此反应,下列叙述正确的是
A、使用催化剂不改变反应速率 B、降低压强能加大反应速率
C、升高温度能加快反应速率 D、改变压强对反应速率无影响。
7、下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多
D.常温时,A能从酸中置换出氢,而B不能
8、无机化学命名委员会(国际组织)在1999年作出决定,把长式周期表原先的主副族序号取消,由左到右按原顺序编为18列,稀有气体为第18列,按这个规定,下列说法正确的是 ( )
A.第三列所含元素最多
B.从上到下第一列元素单质熔点逐渐升高,而第17列元素单质熔点逐渐降低
C.从上到下第一列元素单质密度逐渐升高,而第17列元素单质密度逐渐降低
D.第18列最外层电子数均为8,化学性质十分稳定
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9、将X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流由W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属活动性顺序是
A、X>Z>W>Y B、Z>X>Y>W C、X>Y>Z>W d、Y>W>Z>X
![]() 10、在一定条件下,向2L密闭容器中加入2molN2和10molH2发生反应
10、在一定条件下,向2L密闭容器中加入2molN2和10molH2发生反应![]() ,2min时,测得剩余N2为1mol,对于这化学反应速率表示不正确的是
,2min时,测得剩余N2为1mol,对于这化学反应速率表示不正确的是
A、![]() B、
B、![]()
C、![]() D、
D、![]()
11、把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是
A.增大亚硫酸钠粉末的量。 B.硫酸浓度增大一倍,用量减少到原来的1/2。
C.硫酸浓度不变,用量增大一倍。 D.使反应在较高温度下进行。
12.下列叙述正确的是
A.电能是一级能源 B.水力是二级能源
C.天然气是一级能源 D.水煤气是一级能源
![]() 13、.在一定条件下,将A2和B2两种气体通入密闭容器中,反应按xA2+yB2 2C进行,2秒钟后反应速率如下:
13、.在一定条件下,将A2和B2两种气体通入密闭容器中,反应按xA2+yB2 2C进行,2秒钟后反应速率如下:![]() ,
,![]() ,
,![]() 则x、y的值分别为
则x、y的值分别为
A、3和2 B、1和3 C、3和1 D、4和5
14、.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.![]() 原子核内含有4个质子
原子核内含有4个质子
B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子
原子核内含有3个中子
D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
15、下列关于稀有气体的叙述不正确的是
A. 原子的最外电子层都有8个电子
B. 其原子与同周期IA、IIA族阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.原子半径比同周期ⅦA族元素原子的大
16、、对于某反应x+3y=2E+2F在甲、乙、丙、丁四种不同条件下。分别测得反应速率为甲:![]() ;乙:
;乙:![]() ;丙:
;丙:![]() ;丁:
;丁:![]() ,则反应最快的是
,则反应最快的是
A、甲 B、乙 C、丙 D、丁
得分
Ⅰ 卷答题卡:
卷答题卡:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共52分)
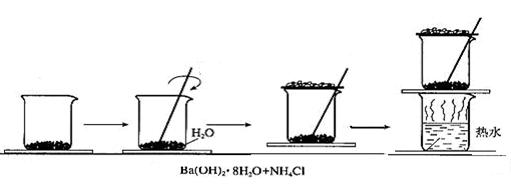 17、(10分)在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量的变化实验方案和实验步骤如下如下图,根据下面实验方案和步骤回答下列问题:
17、(10分)在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量的变化实验方案和实验步骤如下如下图,根据下面实验方案和步骤回答下列问题:
(1)、写出氢氧化钡晶体与氯化铵晶体反应的化学方程式
。
(2)、填写下表:
| 实验步骤 | 实验现象 | 得出结论 |
| 将晶体混合后立即用玻璃棒快速搅拌混合物 | ||
| 用手触摸烧杯下部 | ||
| 用手拿起烧杯 | ||
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起 |
18(13分)有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如下图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
| X | |
| Y | Z |
(1)各元素的符号是:X Y Z T U
(每空1分共5分)
(2)Y原子的结构示意图 (1分)
(3)用电子式表示Y与T组成的化合物的形成过程: (2分)
 (4)YX2和U2Y反应的化学方程式
。(2分)其中氧化剂是 ,被氧化的是 物质中的 元素(各1分共3分)
(4)YX2和U2Y反应的化学方程式
。(2分)其中氧化剂是 ,被氧化的是 物质中的 元素(各1分共3分)
19、(4分)某温度下, 在 V L 的密闭容器中进行如下反应:
![]() xA(g) +
3B(g)
yC(g). 开始时充入 10a molA和 30a mol B, t 分钟后容器中有 8a mol A和 24a mol B 及 4a mol C, 则x 和 y 的值分别为_____________
xA(g) +
3B(g)
yC(g). 开始时充入 10a molA和 30a mol B, t 分钟后容器中有 8a mol A和 24a mol B 及 4a mol C, 则x 和 y 的值分别为_____________
20、(7分)电子表和电子计算器常用微型银-锌原电池,其电极分别为Ag2O和Zn,电解质溶液是KOH溶液,电极反应分别为:
Zn+2OH--2e =ZnO+H2O Ag2O+H2O+2e =2Ag+2OH-
总的化学方程式为 : (3分)
根据上述变化判断:正极为 ,(2分)负极为 (2分)
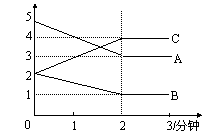 |
21、(8分)某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如右图所示。则该反应的化学方程式为 ;(2分)反应开始至2分钟,能用C表示反应速率吗?
答: (2分)(填“能”或“不能”),
原因
22、(10分)在2L的密闭容器中,加入1mol
H2和3mol N2,发生 N2 + 3H2 ![]() 2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求
2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求
(1)在2s末时NH3的浓度是多少?
(2)用NH3表示该反应的化学反应速率?
答案:
选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | A | C | D | A | C | D | A | C | A、B | B、D | C | A | B | A、B | D |
| 实验步骤 | 实验现象 | 得出结论 |
| 将晶体混合后立即用玻璃棒快速搅拌混合物 | 有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝 | 有NH3气生成 |
| 用手触摸烧杯下部 | 感觉烧杯变凉 | 反应吸热 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部 | 反应吸收热量使体系温度降低,使水结成冰 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起 | 玻璃片脱离上面烧杯底部 | 冰融化 |
17、(1)、Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
18(1)O ,S ,Cl ,Na ,H (每空1分共5分)
|
(2)
(1分)
|
(3)
(2分)
(4)2H2S+SO2=3S+2H2O
(2分) SO2 H2S 硫(![]() )(各1分共3分)
)(各1分共3分)
19、X=1 Y=2(4分)
20、Zn+Ag2O=ZnO+2Ag (3分) 正极为Ag2O (2分) 负极为Ag(2分)
21、2A+B≒2C,(2分)不能 ,(2分)无体积,无法求出浓度变化值 (4分)
22、略