高一化学单元检测题
一、选择题(每题有一个或两个选项符合题意)
1.下列说法正确的是( )
A.锗、硅元素的单质都是半导体材料 B.CH4、SiH4、GeH4的稳定性依次减弱
C.H2CO3、H2SiO3、H2GeO3的酸性依次增强 D.C、Si、Ge、Sn、Pb的熔 、沸点依次升高
2.下列物质中,可做光导纤维重要原料的有( )
| |
高温
![]() 3.SiO2+3C SiC+2CO反应中,还原剂与氧化剂物质的量之比为( )
3.SiO2+3C SiC+2CO反应中,还原剂与氧化剂物质的量之比为( )
A.3∶5 B.5∶3 C.1∶2 D.2∶1
4.下列说法正确的是( )
A.SiO2晶体易溶于水,水溶液呈现酸性
B.CO2通入水玻璃中可以得到硅酸
C.SiO2是酸性氧化物,它不溶于任何酸
D.高温时SiO2可和Na2CO3反应放出CO2,是制造玻璃的反应之一,生成的Na2SiO3是玻璃成分之一
5.生石灰中往往含有杂质碳酸钙和二氧化硅,检验是否存在这两种杂质最好选用( )
A.水 B.盐酸 C.硫酸 D.烧碱溶液
6.人类已知的化合物,种类最多的是( )
A.第ⅡA族元素的化合物 B.第ⅢA族元素的化合物
C.第ⅣA族元素的化合物 D.第ⅤA族元素的化合物
7.关于硅的下列叙述中,正确的是( )
A.晶体硅与金刚石都是正四面体结构的原子晶体
B.硅酸盐都不溶于水
C.硅与酸、碱都不能发生反应
D.原硅酸和硅酸对应的酸酐都是二氧化硅
8.用足量CO原14g铁的氧化物或铁的氧化物的混和物,将生成的CO2通入澄清的石灰水中, 得到25g沉淀,则该物质不可能是( )
A.FeO、Fe2O3 B.Fe2O3、Fe3O4 C.FeO、Fe3O4 D. Fe2O3
9.在标准状况下,将CO2和CO的混合气体(密度为![]() g/L)充满一盛有 足量Na2O2的密闭器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是( )
g/L)充满一盛有 足量Na2O2的密闭器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是( )
A.存在0.5mol CO B.存在0.125mol O2
C.存在0.25mol Na2CO3 D.存在0.5mol Na2 CO3
10.下列各组物质均属于硅酸盐工业产品的是( )
A.陶瓷、水泥 B.单晶硅、玻璃 C.普钙、漂白粉 D.石英玻璃、石膏
11.可以肯定溶液中大量存在CO2-3的理由是( )
A.加入AgNO3溶液有白色沉淀产生
B.加入酸有无色无味气体产生
C.加入CaCl2溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊 的无色无味气体
D.加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸,反应现象如C所述
12.分析某硅酸盐得如下结果:SiO2 45.7%、Al2O3 38.41%、K2O 12.1%、H2O 4. 42%,该盐的化学式为( )
A.K2O·Al2O3·2SiO2·2H2O B.K2O·Al2O3·4SiO2·H2O
C.K2O·2Al2O3·5SiO2·2H2O D.K2O·3Al2O3·6SiO2·2H2O
13.不另加任何试剂就可以将:①Na2SiO3;②Na2SO2;③CaCl2;④KCl;⑤Ba(NO3)2五种溶液鉴别出来,其鉴别检出的顺序是( )
A.③④⑤①② B.③①⑤②④ C.①③④②⑤ D.③②①④⑤
14.为了干燥CO2并除去混有的少量SO2,混和气应依次通过( )
A.碱石灰,溶H2SO4 B.烧碱,浓H2SO4
C.饱和小苏打溶液,浓H2SO4 D.碳酸钠溶液,浓H2SO4
15.某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是( )
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和水蒸气
C.一定有H2、CO2和HCl D.可能有CO2、NH3和水蒸气
16.玻璃态物质的特点是( )
A.无色透明 B.一定温度范围逐渐软化
C.没有固定的熔点 D.加热后具有流动性
17.关于锗及其化合物的性质叙述中,错误的是( )
A.GeO2不溶于NaOH溶液 B.单质锗具有导电性
C.锗易与盐酸反应放出H2 D.GeO不稳定,易被氧化
18.下列几种情况都有白色沉淀物质生成,其中生成物的化学成分相同的是( )
(1)块状纯碱久置于空气中生成的白色粉末
(2)盛澄清石灰水的烧杯内壁附着的白色物质
(3)生石灰久置于空气中生成的白色物质
(4)Na2SiO3水溶液置于敞口容器中,溶液中出现的白色浑浊
A.(1)、(4) B.(2)、(3) C.(1)、(2) D.(3)、(4)
19.能够解释CO2比SiO2的熔、沸点低的原因是( )
A.C—O键能大于Si—O键能
B.C—O键能小于Si—O键能
C.破坏CO2晶体只需克服分子间作用力,破坏SiO2晶体要破坏Si—O共价键
D.以上说法均不对
20.有一碱性溶液250mL,它可能是NaOH、Na2CO3、NaHCO3中的一种或两种.若加入足量的盐酸,产生的挥发性气体用Ba(OH)2溶液吸收,可得14.775g的白色沉淀物,另取同样体积的该碱性溶液,恰能使浓度为0.625mol/L的NaOH溶液100mL完全反应,该碱溶液的可能组成是( )
A.NaOH、Na2CO3 B.NaHCO3、Na2CO3 C.只含NaHCO3 D.只含Na2CO3
二、填空题
21.BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗 酸铋的简称.若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的价态与铋跟氯形成某 种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成 是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化 物所含氧的总质量相同.请填空:
(1)锗和铋的元素符号分别是 和 .
(2)BGO晶体的化学式是 .
 (3)BGO晶体中所含铋氧化物的化学式是
.
(3)BGO晶体中所含铋氧化物的化学式是
.
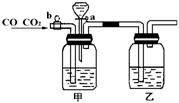
22.实验室用右图的装置将CO2和CO进行分离和干燥.
已知a、b均为活塞,试回答
(1)甲瓶中装的是 溶液,乙瓶中装的是 溶液,分液漏斗中装的是 .
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是 ,活塞操作是 ;然后得到 ,活塞操作是 .
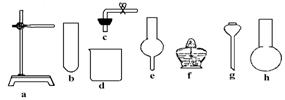 |
23.在没有现成CO2气体发生器的情况下,请你选用如图中部分仪器装配成一个简易的、能 随开随用的、随关随停的CO2气体发生装置.
(1)应选用的仪器是(填入编号) .
(2)若用上面已装配好的实验装置制取CO2气体,而实验室只有稀H2SO4、浓HNO3、 水、块状纯碱、块状大理石.比较合理的方案,你认为应选的药品是 .
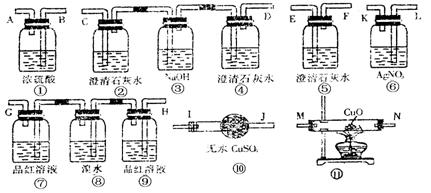 |
24.试用下图所列各装置设计一个实验来确证某无色气体中含有H2、CO2、SO2、HCl、 CO五种气体.
(1)若气体的流向是从左到右,连接上述装置的正确顺序是(填各装置玻璃接口的代码字母)
混和气→( )( )接( )( )接( )( )接( )( )接( )( )接( )( )接( )( ).
(2)确认混合气体中有CO的实验现象是 ,确认混和气体中有H2的实验现象是
(3)装置瓶④的作用是 ,装置瓶⑨的作用是
三、计算题
25.某白色固体由(NH4)2CO3与Na2CO3·nH2O组成,取混和物5.94g溶于足量盐酸中生成气体22.4ml(标况),另取5.94g该固体与足量Ca(OH)2共热,生成的气体通入25mL ,1mol/L的H2SO4溶液中,反应后用25mL,0.5mol/L NaOH溶液恰好中和过量的H2SO4 . 求混和物的Na2CO3·nH2O中n的值.
26.一般窗玻璃里含Na2O为11.7%,CaO 12%,SiO2 75.3%,其余为杂质,现制取50kg窗玻璃,需用原料,NaCO3,CaCO3,SiO2各多少千克?
单元检测参考答案
一、1.AB 2.C 3.D 4.BD 5.B 6.C 7.AD 8.CD 9.B 10.A 11.C 12.D 13 .B 14.C 15.C 16.B 17.A 18.B 19.C 20.B
二、21. (1)Ge、Bi
(2)2Bi2O3·3GeO2
(3)Bi2O3
22.(1)NaOH 浓H2SO4 稀盐酸
(2)CO;打开b,关闭a,
(3)CO2,打开a,关闭b。
23.(1)a、c、d、e
(2)浓HNO3、水、块状大理石
24.(1)L、K、H、G、C、D、B、A、M、N、I、J、E、F
(2)瓶⑤中澄清石灰水变浑浊。
⑩中无水CuSO4变蓝。
(3)确证CO2已被吸收完全;检验有无SO2
二、25.n=5
26.Na2CO3、10kg、CaCO3、10.7kg、SiO2、37.65kg