高一化学第二学期期中考试卷3
化学
(考试时间90分钟,满分100分)
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Cl—35.5 Cu—64
一、选择题(每小题2分,共30分。每小题只有一个选项符合题意)
1.下列各组元素中,非金属性由强到弱顺序排列的是 ( )
A.F、S、CI B.I、C1、Br C.N、C、Si D.O、F、Cl
2.下列物质中,不能用金属单质和非金属单质直接化合的是 ( )
A.CuO
B.![]() C.
C.![]() D.FeS
D.FeS
3.下列各粒子中,氧化性最强的是 ( )
A.![]() B.S
C.Se
D.
B.S
C.Se
D.![]()
4.美科学家将铅和氖两种元素的原子核对擅,获得了一种质量数为293,质子数为118的超重元素,该元素原子核内的中子数是 ( )
A.293 B.175 C.118 D.57
5.酸雨的形成主要是由于 ( )
A.森林遇到乱砍滥伐,破坏了生态平衡 B.燃放烟花爆竹
C.大气中二氧化碳含量增加 D.工业上大量燃烧含硫的燃料
6.同温同压下,等质量的下列气体中,所占体积最小的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
7.某元素R的气态氢化物的化学式为![]() ,则它的最高价氧化物对应水化物的化学式为( )
,则它的最高价氧化物对应水化物的化学式为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.下列各组气体,在通常情况下能共存,并能用浓硫酸干燥的是 ( )
A.![]() B.HBr、
B.HBr、![]()
C.![]() D.
D.![]() 、HCl
、HCl
9.周期元素X和Y的离子![]() 和
和![]() 具有相同的电子层结构.则下列说法正确的是( )
具有相同的电子层结构.则下列说法正确的是( )
A.![]() 的离子半径比
的离子半径比![]() 的小
的小
B.X的原子序数比Y的小
C.X和Y原子的电子层数相同
D.X和Y原子的最外层电子数相同
10.下列化合物中,阳离子与阴离子的半径之比最小的是 ( )
A.CsI B.LiI C.CsF D.NaF
11.下列离子方程式正确的是 ( )
A.铜跟稀硫酸:![]()
B.碳酸钡溶于稀硫酸:![]()
C.![]() 和浓盐酸混合加热制
和浓盐酸混合加热制![]()
D.铝粉和稀![]() 反应制
反应制![]()
12.下列分子中,具有极性键的非极性分子是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.某溶液中加入用盐酸酸化的![]() 溶液,有白色沉淀生成。该溶液中 ( )
溶液,有白色沉淀生成。该溶液中 ( )
A.一定含有![]()
B.一定含有![]()
C.一定含有![]() 和
和![]()
D.可能含![]() 或
或![]() ,或
,或![]() 、
、![]() 都有
都有
14.下列各种情况中、不能用来比较卤族元素非金属性强弱的是( )
A.气态氢化物的稳定性
B.单质溶解度的大小
C.单质间的置换反应
D.最高价氧化物对应水化物酸性的强弱
15.将5mL、0.4mol·![]()
![]() 溶液与10mL、0.3ml·
溶液与10mL、0.3ml·![]()
![]() 溶液混合。反应后溶液中离子浓度最大的是( )
溶液混合。反应后溶液中离子浓度最大的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
二、选择题(每小题4分,共24分。每小题有一个或两个选项符合题意。正确答案只有一个选项的,多选、错选不得分;正确答案有两个选项的,选一个且正确的得 分,选两个都正确的得3分,但只要有一个选错,该小题不得分。)
1.下列为同素异形体的是( )
A.金刚石、![]() B.
B.![]() C.
C.![]() 、
、![]() D.
D.![]()
2.制取相同质量硫酸铜时,消耗硫酸质量最多的是( )
A.铜与浓硫酸在一定条件下反应 B.氧化铜与稀硫酸反应
C.氢氧化铜与稀硫酸反应 D.碳酸铜与稀硫酸反应
3.某金属氧化物化学式为![]() ,每个M离子有10个电子。若其中每个氧原子核内都有8个中子,
,每个M离子有10个电子。若其中每个氧原子核内都有8个中子,![]() 的相对分子质量为102,则M原子核内的中子数为 ( )
的相对分子质量为102,则M原子核内的中子数为 ( )
A.10 B.13 C.14 D.21
4.下列各组物质的性质的递变情况,正确的是 ( )
A.酸性:![]()
B.熔点:![]()
C.稳定性:![]()
D.溶解性:![]()
5.足量的浓![]() 与mg铜完全反应,得到标准状况下
与mg铜完全反应,得到标准状况下![]() ,则被还原的
,则被还原的![]() 是 ( )
是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
6.两份质量相同的![]() 和
和![]() ,它们所含 ( )
,它们所含 ( )
A.氧元素的质量比为5:6 B.硫原子个数比为5:4
C.硫原子个数比为1:1 D.硫元素的质量比1:1
三、题空(每空1分,共26分)
1.将下列现象中硫酸表现出来的性质(吸水性、脱水性、酸性、强氧化性)填在空白处。
(1)敞口放置浓硫酸时,质量增加。______________
(2)把![]() 晶体放入浓硫酸中时,晶体变为白色。______________
晶体放入浓硫酸中时,晶体变为白色。______________
(3)将Zn粒放入稀硫酸中时,有气体放出。_________________
(4)把木屑或纸张放入浓硫酸中时,变黑。__________________
2.现有A、B、C、D四种元素,A、B两种元素的原子各有两个电子层;C、D两种元素的原子各有3个电子层。A和B能形成无色、无味的气体![]() ;C和D能形成离子化合物CD;B和D是同族元素,B的离子和C的离子核外电子数相同,回答下列问题。
;C和D能形成离子化合物CD;B和D是同族元素,B的离子和C的离子核外电子数相同,回答下列问题。
(1)这四种元素的名称和符号是:
A:______B:_______C:________D:________。
(2)A的原子结构示意图为______,C的离子结构示意图为______。
(3)用电子式表示![]() 和CD的形成过程____________。
和CD的形成过程____________。
3.下面是元素周期表的一部分,针对①—⑩元素填写下列空白
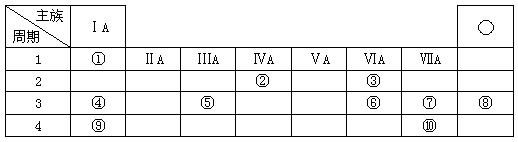
(1)在这些元素中,属于金属元素的有______(填元素符号)
(2)画出⑦元素原子结构示意图_________________________
(3)写出①和⑩形成的化合物的电子式___________________
(4)用电子式表示④和⑥形成化合物的过程_______________
(5)写出①和②的最低价形成气态分子的化学式__________,判断该分子是______(极性、非极性)分子。
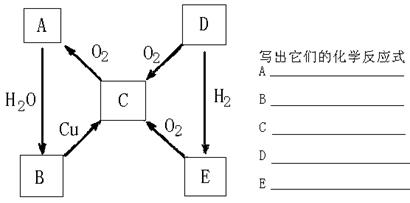
4.A、B、C、D、E是均含硫元素的五种物质,它们相互转化关系如图;
5.A、B、C、D四种可溶性的盐,它们分别由下列阴、阳离子组成(不重复),![]()
![]() 。对四种盐做如下实验:
。对四种盐做如下实验:
(1)分别溶水,只有C盐溶液呈蓝色。
(2)将四种盐溶液分别加盐酸,B盐溶液出现沉淀,D盐溶液中有刺激性气体逸出。则A为________B为______C为________D为______
四、实验(共14分)
1.为验证木炭与浓![]() 反应确实有二氧化硫和二氧化碳气生成,有下列三个装置(木炭与浓
反应确实有二氧化硫和二氧化碳气生成,有下列三个装置(木炭与浓![]() 反应装置省略,并假设C装置将通过且反应的气体完全吸收)
反应装置省略,并假设C装置将通过且反应的气体完全吸收)
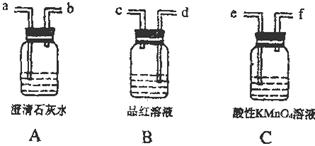
(1)写出木炭与浓![]() 加热时反应的化学方程式________________。
加热时反应的化学方程式________________。
(2)三个装置联接顺序是(填导气管口顺序):气体发生装置导气管口接______,_______接______,_______接______。
(3)装置C的作用是_______________________
(4)装置中的现象是:A中_______________
B中_________________
C中_________________
2.某无色溶液可能由下列离子组成:![]() 。做如下实验。
。做如下实验。
取试样加![]() 溶液,产生白色沉淀,再加足量稀盐酸,沉淀不溶解;再取试样做焰色反应,火焰呈黄色。则该溶液中,肯定存在的离子有_______;肯定不存在的离子有________;不能确定的离子有_______。
溶液,产生白色沉淀,再加足量稀盐酸,沉淀不溶解;再取试样做焰色反应,火焰呈黄色。则该溶液中,肯定存在的离子有_______;肯定不存在的离子有________;不能确定的离子有_______。
五、计算(共6分)
33.用铜与浓硫酸反应,得到![]() 的体积为2.24L(标准状况下)。
的体积为2.24L(标准状况下)。
计算:(1)被还原的硫酸的物质的量
(2)把所得到的硫酸铜配制成500mL硫酸铜溶液,该溶液物质的量浓度是多少?
参考答案
2004.4
一、选择题(30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | B | A | B | D | D | D | D | A | B | C | C | D | B | B |
二、选择题(24分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 答案 | AB | A | C | AD | AD | AB |
三、题空题(26分)
1.(1)吸水性 (2)吸水性 (3)酸性 (4)脱水性
2(1)A—C碳 B—O氧 C—Mg D —S硫
(2)
![]()
(3)![]()
![]()
3(1)Na, Al K
(2)![]()
(3)H Br
(4)![]()
(5)![]() ,非极性
,非极性
4.A——![]() B——
B——![]() C——
C——![]() D——S E——
D——S E——![]()
5.A——![]() B——
B——![]() C——
C——![]() D——
D——![]()
四、(1)![]()
(2)Cl C接e f接a
(3)吸收![]()
(4)A——澄清的石灰水变浑浊
B——品红溶液褪色
C——溶液颜色变浅
2.![]() ;
; ![]() ;
; ![]()
五、
(6)设被还原![]() 物质量为xmol
物质量为xmol
(1)![]() 1分
1分
1 1 22.4
x=0.1mol 22.4 1分
(2)生成![]()
![]() 3分
3分
答:略