高一化学第二学期期中考试试卷
命题:蒋惠英 审定:徐开程
一、选择题(每小题只有一个正确选项)(共30分)
1.下列物质不属于“城市空气质量日报”报道的是
A. 二氧化硫 B. 氮氧化物 C. 二氧化碳 D. 悬浮颗粒
2.在周期表中金属和非金属的分界线附近能找到
A.制农药的元素 B、制催化剂的元素
C.做半导体的元素 D、制耐高温合金材料的元素
3.下列元素中,不能确定为主族元素的是
A. 短周期元素 B. 最外层电子数为5的非金属元素
C. 能形成+2价阳离子的元素 D. 最外层电子数是次外层电子数的3倍多1的元素
4.在短周期元素中,属于非金属元素的有
A.9种 B.10种 C.12种 D.13种
5.X元素的最高价氧化物对应的水化物化学式为H2XO3,则它对应的气态氢化物的化学式为
A.HX B.H2X C.XH3 D.XH4
6.已知铱的一种核素是191 77Ir,则其核内的中子数是
A.77 B.114 C.191 D.268
7.下列物质中既含有离子健,又含有非极性共价键的是
A、Na0H B、H202 C、Na202 D.NaCl
8.关于二氧化硫,下列说法正确的是
①淡黄色的固体 ②易液化 ③能使溴水褪色 ④具有氧化性和还原性 ⑤水溶液具有酸性 ⑥能使品红溶液褪色
A.③④⑤ B.②③④⑤⑥ C.①③④⑤⑥ D.③④⑤⑥
9.下列化合物不能由单质直接化合得到的是
A.CO2 B.SO2 C.SO3 D.FeCl3
10.下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是
A.HClO B.H2O2 C.SO2 D.O3
11.下列有关氧族元素的叙述中正确的是
A.随着原子序数递增,氧族元素的金属性增强 B.氧族元素都具有+6、+4、-2价
C.气态氢化物的稳定性:H2Se>H2S D.钋是容易跟氢气化合的金属
12.一般把pH小于5.6的雨水(包括雨、雪、雾、雹等)称为酸雨,酸雨危害极大。下列能减少酸雨产生的有效措施是
①少用煤作燃料;②把工厂烟囱升高;③燃料脱硫;④在已酸化的土壤中加入石灰;⑤开发新能源。
A.①②⑤ B、①③⑤ C.②③④ D、③④⑤
13.关于9.8g纯硫酸的下列说法错误的是
A.其物质的量是0.1g/mol B.能中和0.2 mol NaOH
C.含有3.2g硫元素 D.含有与12.8g SO2相同的氧原子数
14.储存浓H2SO4的铁罐外口出现严重的腐蚀现象,这是由于浓H2SO4具有
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.不挥发性和酸性
15.已知下列氧化剂均能氧化+4价硫元素,为了除去稀H2SO4中混有的H2SO3,得到纯净的稀H2SO4,应选用的最理想的氧化剂是
A.KMnO4 B.Ca(ClO)2 C.H2O2 D.Cl2
二、选择题(每小题有1-2个正确选项)(共20分)
16.下列物质中,属于同素异形体是
A.02和 03 B、H20和 D20 C.12C和14C D、金刚石和石墨
17.下列结论正确的是
A.稳定性: HF>HCl>H2S B.微粒半径: S>Cl> F
C.金属性:Al>Mg>Na D、酸性:H3PO4>H2SO4>HC1O4
18.某周期ⅡA族元素的原子序数为q,则同周期ⅢA族元素的原子序数为
A.只有q+1 B.可能是q+8或q+18
C.可能是q+2 D.可能是q+1或q+11或q+25
19.检验某未知溶液中是否含有SO42-,下列操作中最合理的是
A.加入硝酸酸化的硝酸钡溶液 B.先加硝酸酸化,在加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液 D.加入盐酸酸化的氯化钡溶液
20.下列各组离子,能在无色溶液中大量共存的是
A.Ag+、K+、I-、NO3- B.H+、Na+、SO32-、MnO4-
C.Ba2+、Al3+、Cl-、SO42- D.H+、Mg2+、Cl-、SO42-
21. 欲除去CO2中混有的少量SO2气体,最好将混合气体通入
A.NaOH溶液 B.澄清石灰水
C.饱和NaHCO3溶液 D.Na2CO3溶液
22.某种金属X的最高化合价为m,它的最高价氧化物对应水化物的分子中有b个氧原子,则这种最高价氧化物水化物的化学式为
A. H2b-mXOb B. H2b+mXOb C. Hm+2bXOb D. Hm-2bXOb
23.下列反应中, 通入气体只作氧化剂的是
(A)二氧化硫通入氢硫酸中 (B)氯气通入氢氧化钠溶液中
(C)硫化氢通入溴水中 (D)氟气通入水中
24.能说明氯的非金属性比硫的非金属性强的是
A.H Cl酸性比H2S酸性强 B.Cl2O7的水化物的酸性强于SO3水化物的酸性
C.H Cl比H2S稳定 D.H ClO的氧化性比SO2强
25、某无色气体可能是HBr、HCl、SO2、CO2中的一种或几种。将气体通入到适量的氯水中,恰好完全反应,不再剩余气体。将所得的无色溶液分装在两支试管中,分别加入酸化的硝酸银溶液、酸化的氯化钡溶液,均产生白色沉淀。根据以上叙述判断以下结论正确的是
A、原气体中一定含有SO2,一定没有HBr B、原气体中可能有SO2
C、原气体中一定含有HCl D、不能确定有无HCl,但一定没有CO2
高一化学第二学期期中考试
答案卷
一、二选择题答案:(每小题2分共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
三、填空题:(22分)
26.在元素周期表短周期中,最活泼的金属元素为 (填化学式,下同),最活泼的非金属元素为 ,最外层电子数是次外层电子数2倍的元素是 ,最高价氧化物水化物酸性最强的酸是
27、36克H2O和80克D2O,它们所含的氧原子个数比是___ __,它们分别跟金属钠完全反应时,放出的气体体积比(同温同压)是___ ____,质量比是_____ ___。
28.离子键的强弱主要决定于离子半径和离子电荷值,一般规律是:离子半径越小,
离子电荷值越大,则离子键越强。试分析:①Na2O、② Al2O3、③MgO三种物质离子键由强至弱的顺序是(填序号)___ ____________。
29.A、B、C、D都是短周期元素,A元素的原于核外有 2个电子层,最外层已达到饱和。B元素的单质在通常情况下为黄绿色气体,C元素的离子带有2个单位的正电荷,它的核外电子排布与A元素的原子相同。D元素与C元素属同一周期,D元素原于的最外层电于数比C元素原子的最外层电子数多1。
(1)写出A、B两元素的元素符号:A ,B ;
(2)C元素位于 周期、 族;
(3)C、D两元素最高价氧化物的水化物碱性强弱(用化学式表示) ;
(4)B与C形成的化合物的是 请用电子式表示其形成过程 。
(5)写出D元素的氧化物与氢氧化钠溶液反应的离子方程式:
四、实验题:(18分)
30.(1)Cu与浓硫酸反应的化学方程式为: 。
(2)工业上制 CuSO4时,先将Cu粉在空气中充分加热,然后再使其和硫酸反应,其中发生反应的化学方程式为 ,
。
与(1)比较,这样做的好处是: 31.( 1)浓硫酸与木炭粉在加热条件下发生反应的化学方程式为
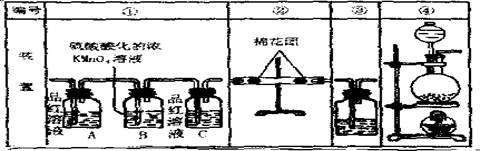 (2)试用下图所列各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
(2)试用下图所列各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 .
(4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 ,可验证的产物 。
五、计算题: (10分)
32.25.2g亚硫酸钠样品,在空气中露置一段时间后烘干,其质量变为26.8g。(提示:亚硫酸钠被氧气氧化的化学方程式为:2Na2SO3 + O2 ==2Na2SO4 )
(1)26.8g物质中含亚硫酸钠多少克?硫酸钠多少克?
(2)若把这部分已氧化的亚硫酸钠溶于水,加入足量的氯化钡溶液,可得白色沉淀多少克?
(3) )若把这部分已氧化的亚硫酸钠溶于适量盐酸,让二氧化硫充分逸出,产生的二氧化硫在标准状况下的体积约是多少升?