高一化学第二学期期中练习
1.本试题共8页,共四道大题。满分100分。考试时间共90分钟。
2.使用蓝色或黑色钢笔或圆珠笔答题。
3.请将选择题答案填入题后的表格中。
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 S:32
Ⅰ卷(选择题,共50分)
一、选择题(每小题只有一个选项符合题意。本大题共有25道小题,每小题2分,共50分)
1.据报道,![]() (钬)具有放射性,可有效地治疗肝癌。下列关于
(钬)具有放射性,可有效地治疗肝癌。下列关于![]() 的表述中,不正确的是
的表述中,不正确的是
A.质子数为67 B.中子数为67
C.核外电子数为67 D.质量数为166
2.在![]() 原子里具有的粒子是
原子里具有的粒子是
A.质子、中子、电子 B.质子、中子
C.质子、电子 D.中子、电子
3.下列原子中,半径最小的是
A.F B. B.Cl
C.Br D.I
4.下列原子结构示意图中,能正确表示![]() 的是
的是
A.![]() B.
B.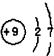
C.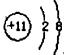 D.
D.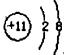
5.下列各组元素中,属于同一周期的是
A.C、O、S B.Si、P、Cl
C.Li、Na、K D.F、Cl、Br
6.下列粒子中,与![]() 具有相同质子数和电子数的粒子是
具有相同质子数和电子数的粒子是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
7.下列各组物质中,互为同位素的是
A.纯碱和烧碱 B.氧气和臭氧
C.石墨和金刚石 D.氘和氕
8.下列含氧酸中,酸性最强的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
9.下列元素中,最高正化合价数值最大的是
A.Na B.Si
C.S D.Cl
10.下列物质中,硫元素化合价只能升高的是
A.![]() B.S
B.S
C.![]() D.
D.![]()
11.下列说法中,不正确的是
A.臭氧层可以吸收来自太阳的大部分紫外线,是人类和生物的保护伞
B.氟利昂对臭氧层起保护作用,所以在工业生产中大力提倡生产和使用氟利昂
C.医疗上广泛使用3%的过氧化氢作为杀菌消毒剂
D.在实验室里可用过氧化氢来制取氧气,为了加快反应速率可用二氧化锰作催化剂
12.下列说法中,不正确的是
A.人们常用“电子云”来描述电子在核外的运动
B.核外电子一般总是尽先排布在能量最低的电子层里
C.道尔顿提出原子是由原子核和核外电子构成的
D.门捷列夫编制了第一个元素周期表
13.元素的性质随着原子序数的递增呈现周期性变化的原因是
A.元素原子的核外电子排布呈周期性变化
B.元素原子的半径呈周期性变化
C.元素原子的电子层数呈周期性变化
D.元素的化合价呈周期性变化
14.对于同一周期从左到右的主族元素,下列说法中,正确的是
A.原子半径逐渐增大
B.元素的金属性逐渐减弱
C.最高正化合价逐渐减小
D.原子的得电子能力逐渐减弱
15.下列有关元素性质递变情况的叙述中,正确的是
A.Li、Be、B原子最外层电子数依次减少
B.P、S、Cl元素最高正价依次降低
C.Na、K、Rb的金属性依次增强
D.N、O、F原子半径依次增大
16.主族元素A、B,已知A的原子序数为12,![]() 离子比
离子比![]() 离子少8个电子,则B的原子序数为
离子少8个电子,则B的原子序数为
A.16 B.18
C.20 D.22
17.短周期元素X、Y,元素X的原子序数为13,元素Y的最外层电子数比次外层少1个电子,元素Y为非金属元素,这两种元素形成的化合物的化学式为
A.NaCl B.![]()
C.![]() D.
D.![]()
18.已知下列元素的原子半径为:
| 原子 | O | N | S | Si |
| 半径( | 0.74 | 0.75 | 1.02 | 1.17 |
根据以上数据,P原子的原子半径可能是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
19.下面各表都表示周期表的一部分,表中的数字表示原子序数,表中数字所表示的元素与它们在周期表中位置关系相符的一组是
A. B. C. D.
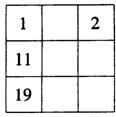
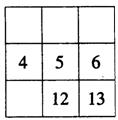
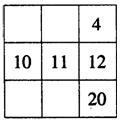
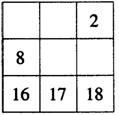
20.下列各组物质中,化学键类型相同的一组是
A.HI和NaI B.NaCl和HCl
C.NaF和KCl D.![]() 和KBr
和KBr
21.下列说法中,正确的是
A.化学键是相邻分子之间强烈的相互作用
B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物
D.化合物中一定不存在非极性健
22.下列电子式表示正确的是
A.![]() :2
:2![]() B.
B.![]()
![]()
C.NaOH: ![]() D.NaCl:
D.NaCl:![]()
23.下列关于氧族元素(不包括钋)的叙述中,正确的是
A.随着原子序数递增,单质的熔点、沸点逐渐升高
B.都能形成+6价化合物
C.都能生成稳定的氢化物
D.随着原子序数递增,元素的非金属性逐渐增强,金属性逐渐减弱
24.能说明氯的非金属性比硫强的事实是
A.HCl是强酸而![]() 是弱酸
是弱酸
B.![]() 的酸性比
的酸性比![]() 强
强
C.HCl![]() 比稳定
比稳定
D.![]() 比HClO稳定
比HClO稳定
25.下列离子方程式中,书写正确的是
A.![]() 溶于水
溶于水 ![]()
B.Na与水反应 ![]()
C.少量![]() 溶于足量NaOH溶液
溶于足量NaOH溶液 ![]()
D.Al和稀![]() 反应
反应 ![]()
请将选择题答案填入表中
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 | 22 | 23 | 24 | 25 | |||||
Ⅱ卷(非选择题,共50分)
二、填空题(共6道小题,共31分)
26.(5分)在第三周期元素中(不包括稀有气体元素),原子半径最大的金属元素是___________,原子半径最小的非金属元素是__________;单质还原性最强的元素是____________;最高价氧化物对应的水化物碱性最强的元素是___________;气态氢化物最稳定的元素是___________。(填元素符号)
27.(5分)下表列出了A~E五种元素在周期表中的位置:
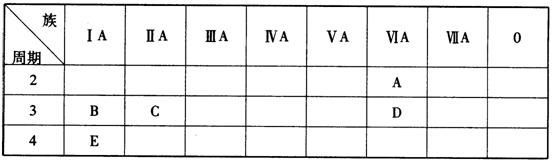
(1)写出下列元素的元素符号:
B__________、D___________、E____________
(2)B、C、E三种元素的氧化物对应的水化物,其中碱性最强的是(填化学式)
___________;A、B、C三种元素按原子半径由小到大的顺序排列为(填元素符号)_____________。
28.(3分)下表是某一周我国部分城市空气质量周报,阅读并回答下列问题。
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | Ⅱ |
| 上海 | 74 |
| Ⅱ |
| 济南 | 76 | TSP | Ⅱ |
| 重庆 | 98 |
| Ⅱ |
注:9SP—可吸入颗粒物
(1)最容易出现酸雨的城市应是____________。
(2)二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L。为减少二氧化硫排放量,下列措施中,可采取的是________(填序号)。
①用天然气代替煤炭做民用燃料②采用燃料脱硫技术③向已酸化的土壤中加石灰④植树造林
(3)事物是有两面性的,例如:二氧化硫对环境有污染,但也有其有用的一面。试举出一个生产、生活实际中应用二氧化硫的例子。
29.(5分)硒(Se)是人体必需微量元素。已知在周期表中,硒与氧同主族,与钙同周期,试回答下列问题:
(1)硒位于周期表第_________周期,___________族;
(2)硒的最高价氧化物的化学式为___________,对应水化物的化学式为_________;
(3)下列有关硒的说法中,正确的是( )
A.硒化氢的稳定性比硫化氢气体弱
B.最高价氧化物对应水化物的溶液显碱性
C.溴和硒是同周期元素,硒的非金属性比溴强
D.只有—2、0、+6三种化合价
30.(5分)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定
区域内寻找新的物质。
(1)人们可以在周期表里金属和非金属的交界处找到半导体材料。
①下列单质中,只有一种物质不能做半导体材料,该物质是( )
A.Si B.S C.Ce D.Se
②GaAs是一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第VA族。Ga和As的最外层电子数分别是_______________、___________;
(2)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。致冷剂应该低毒、不易燃烧,性质稳定。致冷剂氟利昂是科学家求助于周期表中元素及其化合物的易燃性、毒性、沸点等方面的变化趋势开发出来的。
①氢化物的易燃性:
第二周期____________>![]() >
>![]() ;
;
第三周期![]() >
>![]() >
>![]() >
>![]() 。
。
②化合物的毒性:
![]()
![]() _______
_______![]()
![]()
![]()
于是科学家们开始把注意力集中在含F、Cl的化合物上。经过较长时间反复试验,一种新的致冷剂氟里昂![]() 终于诞生了。尽管现在我们知道,氟里昂导致了臭氧层的破坏,但科学家的这种研究思路还是值得肯定的。
终于诞生了。尽管现在我们知道,氟里昂导致了臭氧层的破坏,但科学家的这种研究思路还是值得肯定的。
31.(8分)A元素的原子核外有三个电子层,最外层电子数是K层电子数的1/2,B元素原子的核电荷数比A多2个,C原子核中的质子数比B多4个。试推断:
(1)A是____________元素、B是____________元素、C是______________元素;
(2)A、C两元素形成的化合物的化学式是_____________,该化合物在无色火焰上灼烧时,火焰呈_______________色。
(3)①B元素的最高价氧化物能够和稀盐酸反应,该反应的化学方程式为_______________________。
②向反应后的溶液中滴加NaOH溶液,可以看到有白色絮状沉淀产生,继续滴加NaOH溶液直至过量,沉淀溶解。有关反应的离子方程式为:
_________________________________________________________________
__________________________________________________________________。
三、实验题(共2道小题,共13分)
32.(2分)向晶红溶液中通入足量的![]() ,可观察到的现象是____________;
,可观察到的现象是____________;
反应后将试管中的溶液加热煮沸一段时间,又可观察到的现象是________________。
33.(11分)某课外实验小组同学进行气体的制取和性质验证的研究。他们设计了一套实验装置(如下图),用该装置能够进行多种气体的制取和性质验证实验(进行不同气体的制取和性质验证实验时,可以根据需要增减、调换部分装置)。
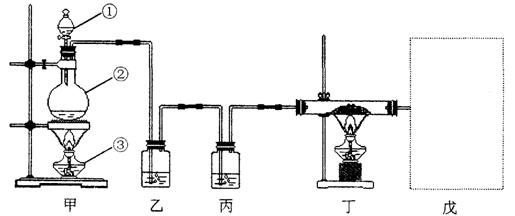
请根据上图回答问题:
(1)写出上图装置中有标号的仪器名称:
①_____________②_____________ ③_____________;
(2)王刚同学查到草酸(![]() )晶体和浓
)晶体和浓![]() 混合加热可以生成CO和
混合加热可以生成CO和![]() (
(![]() )根据此反应,用上图装置制取纯净、干燥的CO,并用CO还原
)根据此反应,用上图装置制取纯净、干燥的CO,并用CO还原![]() 。则乙中盛有NaOH溶液,其作用是_________________________;丙中应盛放的试剂是_____________;戊中的装置应选用下图中的_______________装置(填序号)。
。则乙中盛有NaOH溶液,其作用是_________________________;丙中应盛放的试剂是_____________;戊中的装置应选用下图中的_______________装置(填序号)。
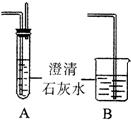
(3)李明同学设计用![]() ,固体跟盐酸加热反应制取纯净的
,固体跟盐酸加热反应制取纯净的![]() ,并使部分
,并使部分![]()
在加热和有催化剂存在的条件下被氧化成![]() 。
。
①试写出![]() 固体跟盐酸加热反应制取
固体跟盐酸加热反应制取![]() 的化学方程式:_____________________________________________;
的化学方程式:_____________________________________________;
②此时乙中盛有的是饱和![]() 溶液,其作用是______________________________;
溶液,其作用是______________________________;
③若戊中的装置选用上图中的B装置,如果要充分吸收尾气,此时在B装置中盛放的液体应该是____________;如果要检验产物中有![]() 生成,可以在反应结束后取少量B装置中的溶液滴加稀盐酸酸化的BaCl:溶液,现象是_____________________。如果要检验
生成,可以在反应结束后取少量B装置中的溶液滴加稀盐酸酸化的BaCl:溶液,现象是_____________________。如果要检验![]() 未完全被氧化成
未完全被氧化成![]() ,此时在B装置中盛放的液体应该是____________。
,此时在B装置中盛放的液体应该是____________。
四、计算题(共1道小题,共6分)
34.(6分)某工厂的燃料煤中含硫的质量分数为0.32%,该厂每天燃烧这种煤100t。试通过计算回答:
(1)如果煤中的硫全部转化为![]() ,每天可产生的
,每天可产生的![]() 在标准状况下的体积为_____________
在标准状况下的体积为_____________![]() ;
;
(2)如果用10mol/L的NaOH溶液吸收这些![]() ,使之完全转化为?
,使之完全转化为?![]() 每天需要消耗NaOH溶液的体积为_______________L。
每天需要消耗NaOH溶液的体积为_______________L。
请写出计算过程。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | A | A | B | B | D | B | D | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | A | B | C | A | B | B | D | C |
| 21 | 22 | 23 | 24 | 25 | |||||
| C | D | A | B | C |
填空题每空一分
26.Na Cl Na Na Cl
27.(1)Na S K
(2)KOH O<Mg<Na
28.(1)重庆
(2)①②
(3)用![]() 漂白有色物质;
漂白有色物质;![]() 能够杀灭霉菌和细菌,可用作食物利于果的防腐剂;以
能够杀灭霉菌和细菌,可用作食物利于果的防腐剂;以![]() 为原料生产硫酸。(答出一个合理答案即给分)本题讲评时,应突出事物的两面性,强调辩证的看问题。
为原料生产硫酸。(答出一个合理答案即给分)本题讲评时,应突出事物的两面性,强调辩证的看问题。![]() 有其有害的一面,但不能只看到或强化这一点。不能只让学生看到化学有害的一面,更应该让学生看到化学对社会发展的贡献。
有其有害的一面,但不能只看到或强化这一点。不能只让学生看到化学有害的一面,更应该让学生看到化学对社会发展的贡献。
29.(1)4 VIA
(2)![]()
![]()
(3)A
30.(1)①B ②3 5
(2)①![]() ② >
② >
本题讲评时,应突出元素周期律的应用。强调元素周期律是指元素的性质随着元素原子序数的递增而呈周期性的变化。而元素的性质不仅仅是课本上介绍的化合价、核外电子排布、金属性、非金属性等,还包括其他很多的性质。
31.(1)Na Al Cl
(2)氯化钠(NaCl) 黄
(3)![]()
![]()
![]()
32.品红溶液逐渐褪色 溶液又变为红色
33.(1)①长颈漏斗②圆底烧瓶③酒精灯
(2)吸收![]() 气体 浓
气体 浓![]() A
A
(3)①![]() ②吸收HCl气体 ③浓的氢氧化钠溶液(只答氢氧化钠溶液给分) 产生白色沉淀 品红溶液本题讲评时,可以进行实验方案设计的评价讨论,如第(3)问设计的
②吸收HCl气体 ③浓的氢氧化钠溶液(只答氢氧化钠溶液给分) 产生白色沉淀 品红溶液本题讲评时,可以进行实验方案设计的评价讨论,如第(3)问设计的![]() 的制法是否合理,能否进行改进?
的制法是否合理,能否进行改进?
成绩比较好的学生可以进行第(3)问中丙装置中药品的讨论。可以是浓硫酸,用来干燥气体。但题目没有要求干燥气体,且由于没有![]() 补充,反应只能进行较短的一段时间,因此不够理想。理想的选择是双氧水,
补充,反应只能进行较短的一段时间,因此不够理想。理想的选择是双氧水,![]() 通过双氧水得到
通过双氧水得到![]() 和
和![]() 的混合气体,正好进入丁装置进行催化反应。
的混合气体,正好进入丁装置进行催化反应。
成绩比较好的学生还可以讨论还有那些气体可以用该套装置进行制取和性质验证。如:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
等
34.解:(1) ![]() …………………………………………1分
…………………………………………1分
32g 22.4L
![]()
![]() ……………………………………1分
……………………………………1分
![]() ………………………1分
………………………1分
(2)![]() ……………………………………………1分
……………………………………………1分
22.4L 2mol
224000L 10mol/L×V(NaOH)……………………………………………1分
![]() ……………………………………………1分
……………………………………………1分