高一化学第二学期期中试卷
一、选择题(每题只一个正确答案)
1.据最新报道,钬的放射性同位素16667Ho可有效地治疗肝癌。该同位素原子核内的中子数与核外电子数之差是:
A.32 B.67 C.99 D.166
2.目前,我国许多城市和地区定期公布空气质量报告,在空气质量报告中一般不涉及:
A.SO2 B.CO2 C.NO2 D.可吸入颗粒物
3.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性 B. 该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
4.168O、188O、O2-、O2、O3是
A.氧元素的五种不同微粒 B.五种氧元素
C.氧的五种同素异形体 D.氧的五种同位素
5.下列各分子中,所有原子都满足最外层电子为8电子结构的是
A.CCl4 B.BF3 C.H2O D.PCl5
6.下列说法正确的是
A.离子化合物中可能含有共价键,但一定含有金属元素
B.共价化合物中一定含有共价键
C.离子化合物中不存在非极性键
D.由两种元素形成的化合物一定不含非极性键
7.某酸雨样品刚采集时测得PH = 4.82,放在烧杯中经2小时后,再次测得PH = 4.68。以下对该雨水的判断正确的是:
A.雨水样品酸性逐渐减小 B.雨水样品酸性没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3逐渐被氧气氧化成H2SO4
8.下列电子式正确的是:
A. B. C. D.
9.下列说法中不正确的是:
①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子的组合 ④电子数相同的粒子不一定是同种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
10.四种主族元素的离子aX m+、bY n+、cZ n—和dR m—(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是:
①a-b = n-m ②元素的原子序数a>b>c>d ③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y
A.只有③正确 B.①②③④正确
C.①②③正确 D.②③正确
11.下列物质性质判断不正确的是:
A.沸点:F2<Cl2 B.溶解性:Na2CO3>NaHCO3
C.密度:氨水>水 D.酸性:HClO4>H2SO4
12.下列说法正确的是:
A.二氧化硅是酸性氧化物,它不溶于任何酸
B.SO2通入某有色溶液中,溶液颜色褪去或变淡,表现了SO2的漂白性
C.SO2通入澄清石灰水的现象是:先有浑浊,后又澄清
D.木炭与浓H2SO4反应产生的气体,能使BaCl2溶液变浑浊
13.根据理论研究,元素周期表可容纳164种元素。理论上164号、114号、14号元素位于同一主族。根据你所学的知识,下列预测肯定不正确的是:
A.164种元素是金属元素 B.164种元素位于ⅣA族
C.164种元素对应的最高价氧化物的水化物其碱性比114号强
D.164种元素存在稳定的气态氢化物,且还原性比SiH4弱
14.已知同周期的X. Y. Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是:
HZO4>H2YO4>H3XO4,下列判断正确的是( )
A.原子得电子的能力按X、Y、Z的顺序减弱
B.原子半径按X、Y、Z的顺序减小
C.氢化物的稳定性按X、Y、Z的顺序减弱
D.阴离子的还原性按X3-、Y2-、Z-顺序增强
15.X和Y两元素的阳离子具有相同的电子层结构。X元素的阳离子半径大于Y元素的阳离子半径。Z和Y两元素的核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。则X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X
二、选择题:(每题有1~2个正确答案)
16.鉴别CO2和SO2,可将它们分别通人
A.盛有澄清石灰水的洗气瓶 B.盛有品红溶液的洗气瓶
C.盛有氯化钡溶液的洗气瓶 D.盛有溴水的洗气瓶
17.下列除去杂质的方法正确的是:
A.除去CO2中的少量SO2:将气体通过饱和的Na2CO3溶液,再收集
B.除去Na2SO3溶液中的少量Na2SO4:加入足量的H2O2溶液
C.除去H2S中的少量HCl:将气体通过饱和的NaHS溶液,再收集
D.除去CO2中的少量CO:用酒精灯点燃
18.一定条件下,RO3—与R—可发生反应:RO3— + 5R— + 6H+ = 3R2 + 3H2O
下列关于R元素的叙述中,正确的是:
A.R可能位于元素周期表的ⅤA族或ⅦA族
B.R的气态氢化物的水溶液是强酸
C.RO3—中的R只能被还原 D.R2在常温常压下一定是气体
19.表示下列化学反应的离子方程式不正确的是:
A.H2S气体通入足量的NaOH溶液中: H2S + 2OH— = S2— + 2H2O
B.过量的CO2通入澄清石灰水:CO2 + OH— = HCO3—
C.少量的SO2气体通入NaClO溶液中:SO2 + 2ClO— + H2O = SO32— + 2HClO
D.碳酸钡中滴加稀硫酸:BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O
20.吸进人体内的O2有约2%转化为氧化性极强的活性氧副产物(如O2—),这些活性氧能加速人体衰老,被称为“夺命杀手”。人们尝试:①用含硒化合物Na2SeO3消除人体内活性氧;②在护肤品中加入SOD(超氧化物歧化酶),促使O2—等转化为双氧水、氧气等,从而消除体内活性氧。在消除活性氧时,下列说法不正确的是:
A.方法②护肤品中加入的SOD是消除体内活性氧的催化剂
|
![]() B.方法②的反应可表示为:2O2— + 2H2O
H2O2 + O2 + 2OH—
B.方法②的反应可表示为:2O2— + 2H2O
H2O2 + O2 + 2OH—
C.方法①可取,因为Na2SeO3可做还原剂,且硒又是人体内一种必需微量元素
D.方法①不可取,因为Na2SeO3不可做还原剂,且硒对人体有害。
三、填空题:
21.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代氯气成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,同时生成硫酸钠。写出反应的化学方程式: 。
22.X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子层数的2倍,Z元素是植物生长的重要营养元素。请回答下列问题:
⑴ 推断X、Y、Z的元素:X ,Y ,Z 。
⑵ 最近科学家们合成了Z5n+,电子式为 ,则n值为 。
⑶ Z与X可形成多种化合物,其中ZX3的结构式为 ,Z2X4的电子式为 (用判断出的元素符号表示)
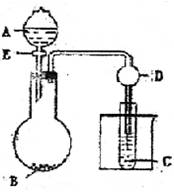
23.用下图所示装置进行实验,将A逐滴加入B中:
(1)若A为浓H2SO4,B为第三周期金属元素的单质,
其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是 (化学式),B与浓H2SO4反应的方学方程式为 ;反应后往烧杯中加入沸水,又可观察到试管C中的现象为 。
(2)若B为Na2CO3,C为Na2CO3饱和溶液溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是 。然后往烧杯中加入沸水,可观察到试管C中的现象是 ,试分析该现象的原因: 。
![]()
![]()
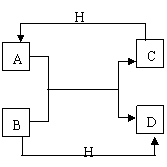
![]() 24.已知A、B、C、D是中学化学常见的不同微粒。它们之间在化学反应时存在如下关系:
24.已知A、B、C、D是中学化学常见的不同微粒。它们之间在化学反应时存在如下关系:
⑴ 如果A、B、C、D均是10电子的微粒,且A不是双
原子分子,请写出:
A的结构式 ;D的电子式
⑵ 如果A、B、C、D均是10电子的微粒,且A是双原
子分子,则C为 ;A与B在溶液中反应的
离子方程式: 。
⑶ 如果A、C是18电子的微粒,B、D均是10电子的微粒,
则A是 ,B是 ,A、B反应的离子方程式 。
25.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去,必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
| 气体 | a | b | c | d |
| HCl | 浓H2SO4 | NaCl | NaOH溶液 | 浓H2SO4 |
| Cl2 | 浓HCl | KMnO4 | 饱和NaCl溶液 | 浓H2SO4 |
| H2S | HCl | FeS | 饱和NaHS溶液 | 浓H2SO4 |
| SO2 | 浓H2SO4 | Na2SO3 | —— | 浓H2SO4 |
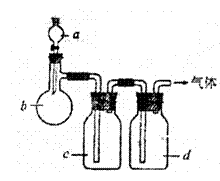 (1)上述方法中可以得到干燥、纯净的气体是
。(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
(1)上述方法中可以得到干燥、纯净的气体是
。(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
26.喀麦隆的“杀人湖”曾于1986年使1800多名附近居民在一夜之间神秘死去,后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体,在200m深的湖底,每立方米湖水中竟溶解了8m3的有毒气体。
⑴为了测定从湖底取出的水样中SO2的含量,可在一定量的水样中加入一定量的碘(过量),再用已知浓度的硫代硫酸钠溶液与过量的碘反应,该反应为:2Na2S2O3+I2=2NaI+Na2S4O6
①碘和水样中SO2反应的化学方程式: 。
②用硫代硫酸钠与过量的碘反应时,先在水样中加1~2滴 ,当出现 (填现象),恰好完全反应。
③若在20mL水样中加入碘Wg,用去VmL C mol/L的Na2S2O3溶液,则水样中SO2的浓度为多少?(写出有关计算过程)
⑵为了测定从湖底抽出的有毒气体中CO2的含量,需将CO2变成沉淀,然后测其质量,通过计算求出CO2的含量,从下图中选择必要的装置(导管等省略)设计实验将CO2转变为沉淀。
①其所选装置的连接顺序是(按从上到下,从左到右的顺序) 。
②将气体两次通过酸性KMnO4溶液的目的是
③是否需要装置B,为什么? 。
④为了测得沉淀的质量,还需进行的操作是 ;还需要的仪器有 。
高一化学第二学期期中试卷答卷
原子量:H~1 Na~ 23 O~ 16 S~32 I~127
一、选择题(每题只一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 |
二、选择题(每题有1~2个正确答案)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题:
21. 。
22.⑴ , ,
⑵ ,⑶ ,
23.⑴ , , 。
⑵ , , 。
24.⑴ ,
⑵ ,
⑶ , , 。
25.⑴ ,
⑵ ,
,
,
,
26.⑴ ①
② ,
③
⑵ ① ②
③
④ ,