高一化学第二学期期终试卷
高 一 化 学
命题:朱季华 审核:许洪福
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23
S—32 Cl—35.5 Fe—56 Zn—65
此卷所有答案请填写在答卷纸上。
一、 选择题(本题包括8小题,每小题只有一个选项符合题意。)
1.你认为减少酸雨产生的途径可采用的措施是
① 少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④ 在已酸化的土壤中加石灰 ⑤开发新能源
A ①②③ B ②③④⑤ C ①③⑤ D ①③④⑤
2.2003年2月1日美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨
A 具有导电性,防辐射 B 密度小,减轻机身质量
C 熔点高,化学性质稳定 D 硬度小,有润滑作用
3.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt W ü thrich 等人为此获得2002年诺贝尔化学奖。下面关于13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
4.下列物质长时间放在敞口瓶里,会发生变质的是
① 硅酸钠溶液 ② 亚硫酸钠溶液 ③ 过氧化钠 ④ 次氯酸钙
A ③ B ①②③ C ②③④ D ①②③④
5.下列各离子化合物中,阴离子对阳离子的半径之比为最小的是
A KCl B NaBr C LiI D KF
6.下列叙述正确的是
A 同主族元素自上而下,金属性减弱
B 同主族元素自上而下,得电子能力增强
C 同周期元素中,IA族元素的原子半径最小
D 同周期元素中,ⅦA族元素气态氢化物最稳定
高一化学 第1页共5页
7.下列物质的主要成分不含硅酸盐的是
A 石英玻璃 B 陶瓷 C 普通水泥 D 高岭土
8.下列说法中不正确的是
① 质子数相同的粒子一定属于同种元素
② 同位素的性质几乎完全相同
③ 质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
④ 电子数相同的粒子不一定是同一种元素
⑤ 一种元素只能有一种质量数
⑥ 某种元素的相对原子质量取整数,就是其质量数。
A ①②④⑤ B ③④⑤⑥ C ②③⑤⑥ D ①②⑤⑥
二、 选择题(本题包括10小题,每小题有一个或两个选项符合题意。)
9.已知:H2SeO3 + 2SO2 + H2O = Se + 2H2SO4,结合所学知识判断下列关系中正确的是
A 氧化性:TeO2>SeO2>SO2 B 还原性:TeO2>SeO2>SO2
C 还原性:H2Te<H2Se<H2S D 酸性:H2SeO3>H2SO4
10.下列固体融化(或熔化)时必须破坏非极性共价健的是
A 冰 B 晶体硅 C 溴 D 二氧化硅
11.关于晶体的下列说法正确的是
A 在晶体中只要有阴离子就一定有阳离子
B 在晶体中只要有阳离子就一定有阴离子
C 原子晶体的熔点一定比金属晶体的高
D 分子晶体的熔点一定比金属晶体的低
12.对某酸性溶液(可能含有Br—、SO42—、H2SO3、NH4+)分别进行如下实验;
① 加热时放出的气体可以使品红溶液褪色
② 加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝
③ 加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在原溶液中是否存在的是
A Br— B SO42— C H2SO3 D NH4+
13.下列各组离子在无色溶液中能大量共存的是
A Na+、HS—、Cu2+、Cl— B HS—、Na+、OH—、K+
C K+、CO32—、Br—、OH— D H+、Cl—、Na+、SO32—
高一化学 第2页共5页
14.以NA表示阿伏加德罗常数,下列说法中正确的是
A 标准状况下,11.2L三氧化硫中含有的分子数为0.5NA
B 1.8g的NH4+离子中含有的电子数为NA
C 常温、常压下,48g臭氧含有的氧原子数为3NA
D 常温、常压下,11.2L氧气所含原子数为NA
15.能正确表示下列化学反应的离子方程式是
A 过量的硫酸氢钠与氢氧化钡溶液反应 Ba2++2OH—+2H++SO42—= BaSO4↓+ 2H2O
B 用碳酸钠溶液吸收少量二氧化硫 2CO32— + SO2 + H2O = 2HCO3— + SO32—
C 饱和石灰水跟稀硝酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2O
D 金属钠跟水反应 Na + 2H2O = Na+ +2OH— + H2↑
16.甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀盐酸,向甲烧杯中加入m g铁,向乙烧杯中加入m g锌,完全反应后,发现有一烧杯中仍有金属剩余,若稀硫酸的物质的量浓度为x mol/L,则x的范围是
A ![]() B
B ![]() C
C ![]() D
D ![]()
17.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A 2 B 3 C 4 D 5
18.下列实验过程中产生的现象与对应的图形相符合的是
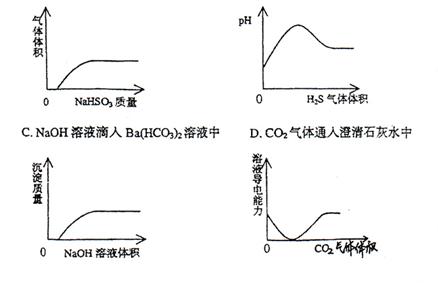 A.NaHSO3粉末加入HNO3溶液中 B. H2S气体通入氯水中
A.NaHSO3粉末加入HNO3溶液中 B. H2S气体通入氯水中
高一化学 第3页共5页
三、(本题包括2小题)
19.要配制浓度约为2mol·L-1NaOH溶液100mL,下面的操作正确的是_____(填代号)
A 称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加
入烧杯中,同时不断搅拌至固体溶解
B 称取8 g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体
完全溶解后用蒸馏水稀释至100mL
C 称取8 g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固
体溶解,再加水到刻度,盖好瓶塞,反复摇匀
D 用100mL量筒量取40mL 5mol·L—1 NaOH溶液,倒入250mL烧杯中,再用同一
量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
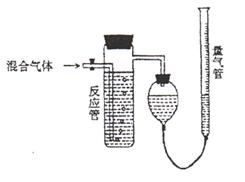 20.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉
20.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉
溶液。SO2和I2发生反应(N2、O2不与I2反应):
(1)混合气体进入反应管后,量气管内增加的
水的体积等于_________的体积(填写气体
的分子式)
(2)反应管内溶液蓝色消失后,没有及时停止
通气,测得的SO2含量_______(选填:偏
高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用
_____________代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为C mol·L—1。
N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为:______________________________________________________
四、(本题包括2小题)
21.周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合
物时原子数之比为1:2。写出这些化合物的化学式_______________________。
22.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构
特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核个数 | 单核 | 单核 | 单核 | 多核 | 双核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 2+ | 0 | 1- | 1+ | 0 |
其中b的离子半径大于c的离子半径;d是由极性键构成的四原子极性分子;e与f可形成两个共价型g分子。试写出:
(1)a微粒的原子结构示意图__________________;
(2)b与c相应元素的最高价氧化物对应水化物的碱性强弱比较为_______>______(用
化学式表示);
高一化学 第4页共5页
(3)d微粒的电子式 ① ,它的结构呈 ② 形;
(4)e微粒是 ① ,f微粒是 ② (用化学式表示);
(5)g微粒所构成的晶体类型属_________晶体。
五、(本题包括2小题)
23.过氧化氢(H2O2)俗名双氧水,医疗上可作外科消毒剂。
(1)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水
具有___________性。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出
______性。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水“清洗”后又恢复原貌,
有关反应的化学方程式为_______________________________。
(4)如果将9.60×10—4mol AO4— 在溶液中还原成较低价态,需用0.100mol/L双氧水溶
液24.0mL,试通过计算确定A元素的最终价态为_________。
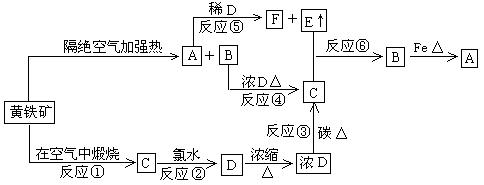 24.下图表示由黄铁矿为开始反应物的一系列变化,其中不含硫的反应产物已略去。
24.下图表示由黄铁矿为开始反应物的一系列变化,其中不含硫的反应产物已略去。
(1)写出化学式:A _______ B_________ C__________ D________ E_________
(2)写出化学方程式: ①_________________ ③_________________
④_________________ ⑥_________________
(3)写出离子方程式: ②_________________ ⑤_________________
六、(本题包括2小题)
25.在一定温度下,有530g Na2CO3溶液,其质量分数为25%,向该溶液中通入过量的CO2气体,完全反应后,经测定共析出不含结晶水的盐180g。试求在该温度下,析出盐的溶解度。
26.用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵。[2NH3+H2SO4=(NH4)2SO4],燃烧
含FeS2 80%的黄铁矿75 t,生产出79.2 t 硫酸铵。若在制取硫酸铵时硫酸的利用率为
90%,则用黄铁矿制取硫酸时的损失率为多少?
高一化学期终答案
一、1.C 2.C 3.C 4.D 5.D 6.D 7.A 8.D
二、9.A 10.B 11.A 12.B 13.C 14.BC 15.AB 16.B 17.D 18.D
三、19. AD
20.(1)N![]() O
O![]() (2)偏低
(2)偏低
(3)酸性KM![]() 溶液或溴水(氯水)
溶液或溴水(氯水)
(4)![]()
21. N![]() O K
O K![]() S M
S M![]() F
F![]() C
C![]() Cl
Cl![]()
![]()
![]()
![]()
![]()
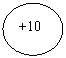 22.(1)N
22.(1)N![]() 2 8
2 8
(2)N![]() OH M
OH M![]() (OH)
(OH)![]()
(3) ![]() 三角锥 (4)OH
三角锥 (4)OH![]() H
H![]() O
O![]()
(5)分子晶体
五、
23.(1)氧化性 (2)还原性
(3)P![]() S+4H
S+4H![]() O
O![]() =P
=P![]() SO
SO![]() +4H
+4H![]() O
O
(4)+2
24. (1)A. F![]() S B.S C. SO
S B.S C. SO![]() D. H
D. H![]() SO
SO![]() E. H
E. H![]() S
S
(2) 1 4F![]() S
S![]() +11O
+11O![]()
![]() 2F
2F![]()
![]() O
O![]() +8SO
+8SO![]()
3
C +2H![]() SO
SO![]() (浓)
(浓)![]() CO
CO![]()
![]() +2SO
+2SO![]()
![]() +2H
+2H![]() O
O
4
S+2H![]() SO
SO![]() (浓)
(浓) ![]() 3SO
3SO![]()
![]() +2H
+2H![]() O
O
6 2H![]() S+ SO
S+ SO![]() =3S
=3S![]() +2H
+2H![]() O
O
(3) 2 SO![]() +Cl
+Cl![]() +2H
+2H![]() O=4H
O=4H![]() +SO
+SO![]() +2Cl
+2Cl![]()
5
F![]() S+ 2H
S+ 2H![]() =F
=F![]()
![]() +H
+H![]() S
S![]()
六
25 N![]() CO
CO![]() +CO
+CO![]() + H
+ H![]() O=2 N
O=2 N![]() H CO
H CO![]()
106g 44g
2![]() 84g
84g
530g![]() m(CO
m(CO![]() )
m(N
)
m(N![]() H CO
H CO![]() )
)
m(CO![]() )=55g m(N
)=55g m(N![]() H CO
H CO![]() )=210g
)=210g
![]() S=8g
S=8g
26
. F![]() S——2 H
S——2 H![]() SO
SO![]() ——2(NH
——2(NH![]() )
)![]() SO
SO![]()
120t
2![]() 132t
132t
75t![]() 79.2t
79.2t
x=33.3%
高一化学 第5页共5页