![]()
硫和硫的化合物1 姓名 学号 班级 一( )
1.下列叙述不符合氧族元素随核电荷数的增加而引起的性质递变规律的是( )
A.它们单质的熔、沸点逐渐升高 B.它们的密度逐渐变大
C.它们的非金属性逐渐增强 D.它们的金属性逐渐增强
2.实验室制备SO2气体,下列方法可行的是 ( )
A.Na2SO3溶液与HNO3 B.Na2SO3溶液与稀盐酸
C.Na2SO3与H2S溶液 D.Na2SO3固体与浓H2SO4
3.下列物质长久放置后,因被空气氧化而变质的是 ( )
A.NaOH溶液 B.Na2SO3溶液 C.澄清石灰水 D.氯水
4.关于SO2和SO3的说法错误的是:①都是酸酐,②与水化合都能生成相应的酸,③都能 与碱反应生成正盐或酸式盐,④通常条件下都是气体,⑤都有还原性( )
A.①④ B.④⑤ C.③⑤ D.②③
5.下列溶液中,不能区别SO2和CO2气体的是 ( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液
⑥品红溶液
A.①②③⑤ B.②③④⑤ C.只有① D.①③
6.下列对硒元素的有关叙述正确的是 ( )
A.硒化氢较硫化氢稳定 B.单质硒是一种半导体材料
C.H2SO4、H2SeO4的酸性依次减弱 D.Cu + Se CuSe
7.钋是核电荷数最大的氧族元素,推测钋及钋的化合物最不可能存在的性质是( )
A.钋是能导电的固体 B.钋与氢气不可能直接化合
C.钋的氧化物的水化物至少有两种 D.钋的氢化物很稳定
8.下列说法错误的是 ( )
A.Na2SO3与BaCl2溶液作用,有白色沉淀,加稀硝酸后沉淀不消失
B.将SO2气体通入Ba(OH)2溶液中有白色沉淀生成
C.将SO2气体通过BaCl2溶液中有白色沉淀生成
D.将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成
9.已知:①硫酸比氯酸稳定;②硫酸的酸性弱于高氯酸;③H2S比HCl易被氧化;④HCl比H2S更容易由单质合成;⑤盐酸的酸性比H2S的酸性强。上述事实能够说明硫的非金属性比氯弱的是 ( )
A.①②③ B.③④⑤ C.②③④ D.①③⑤
10.含有硒的保健品已开始进入市场。已知硒元素与钾元素同周期,则下列有关硒的叙述不 正确的是 ( )
A.原子序数为24 B.气态氢化物H2Se
C.非金属性比溴弱 D.最高价含氧酸为H2SeO4
11.为了除去混在CO2气体中的SO2和O2气,下列试剂的使用顺序正确的是( )
(1)饱和Na2CO3溶液 (2)饱和NaHCO3溶液 (3)浓H2SO4
(4)灼热铜网 (5)碱石灰
A.(1)(3)(4)B.(2)(3)(4)C.(2)(4)(3)D.(3)(4)(5)
12.能作为实验室制取气体的反应是 ( )
A.铜与浓硫酸在常温下反应制取SO2 B.用大理石与稀硫酸反应制取二氧化碳
C.Zn与稀H2SO4制取氢气 D.氯化钠固体与浓硝酸反应制取氯化氢
13.在复印室工作时会闻到一种特殊的气味,离复印机越近,该气味就越浓,若用润湿的
KI淀粉试纸接近该气体,则试纸会变蓝。此物质的化学式是 ,它与
KI溶液反应的离子方程式为 。
14.在二氧化锰粉末中加浓盐酸产生气体A。在亚硫酸钠溶液中加入硫酸产生气体B。将A.B 两种气体按1:1的体积比混合并通入品红溶液中,现象是 , 原因是 。
15.近闻日本和美国正研究用亚硫酸钠吸收法作为治理SO2污染的一种新方法,第一步是用亚硫酸钠水溶液吸收SO2;第二步是加热吸收液,使之重新生成亚硫酸钠,同时得到含高浓度SO2的水蒸气副产品,写出上述两步反应的化学方程式。
(1) (2)
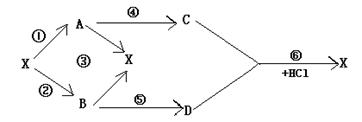
|
则(1)X、A.B.C.D的化学式为:X A B C D 。
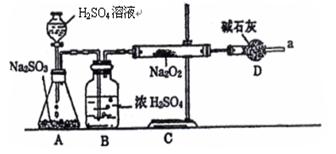 17、某同学通过下列装置进行实验,推断SO2与Na2O2反应的产物,已知SO2可由
17、某同学通过下列装置进行实验,推断SO2与Na2O2反应的产物,已知SO2可由
浓H2SO4与Na2SO3反应制取,Na2O2完全反应。
(1)怎样确定反应中是否有O2生成? 。
(2)B的作用是 ,
装置D的作用是 。
(3)该同学为了确定另一产物是Na2SO3还是Na2SO4,设计实验如下:
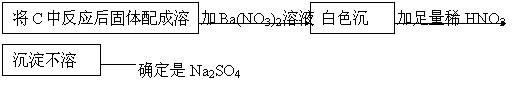 |
你认为该同学的实验是否合理 ,理由是 。
若你认为不合理,请你设计一个合理实验来确定产物(括号内填加入物质,方框内填现象);若你认为合理,可不回答此问。
![]()
18.1L 0.1mol/L的NaOH溶液吸收0.8mol SO2,求所得溶液中的溶质及物质的量。
硫和硫的化合物2
( )1、反应3S+6KOH====K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数比为
A.1∶2 B.2∶1 C.1∶1 D.3∶2
( )2、下列粒子只能作还原剂的是①S ②S2-
③SO![]() ④SO
④SO![]() ⑤Cl-
⑥Na
⑤Cl-
⑥Na
A.①②④ B.②⑤⑥ C.①⑤⑥ D.②④⑤
( )3、下列离子方程式中不正确的是
A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
B.碘化钾溶液跟适量溴水反应:2I-+Br2====I2+2Br-
C.将金属钠加入水中:Na+2H2O====Na++2OH-+H2↑
D.将Cl2通入亚硫酸溶液中:Cl2+H2SO3+H2O====H++SO![]() +2Cl-
+2Cl-
( )4、下列各组物质的性质及粒子变化正确的是
A.酸性:HClO4>H2SO4>H3PO4>H2CO3 B.稳定性:H2S>HCl>HBr>HI
C.粒子半径:Br->K+>S2->S D.还原性:Na>S2->Br->Cl-
( )5、.在氧气中燃烧0.4克硫和铁组成的化合物样品,使其中硫全部转化为SO2,又全部转化为硫酸,这些硫酸可以跟20毫升0.5摩/升的NaOH溶液完全中和,原化合物中硫的百分含量是
A.40% B.46% C.53% D.73%
( )6、已知在FeSO4和Fe2(SO4)3组成的混和物中,硫元素的质量百分含量为a%,则混和物中铁元素的质量百分含量为
A.(100-a)% B.(100-2a)% C.(100-3a)% D.(100-4a)%
( )7、下列物质能使品红溶液褪色的是①干燥的Cl2 ②Na2O2 ③O2 ④活性炭 ⑤SO2
A.除①外其他都可以 B.只有①②③ C.只有①④⑤ D.全部都可以
( )8、下列广告用语在科学上没有错误的是
A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素 D.没有水就没有生命
( )9、下列反应中,SO2不是作为还原剂而发生反应的是
![]()
|
C.SO2+2H2S====3S↓+2H2O D.SO2+Cl2+2H2O====H2SO4+2HCl
( )10、下列反应中,调节反应物用量或浓度不会改变反应产物的是
A.H2S在氧气中燃烧 B.铁在硫蒸气中燃烧
C.二氧化硫通入石灰水中 D.硫酸中加入锌粉
( )11、下列反应中,不能产生黑色固体的是
A.铜在硫蒸气中燃烧 B.铁丝在氧气中燃烧
C.氯气与硫化氢气体混和 D.氯化锌溶液与硫化钠溶液混和
( )12、能在空气中稳定保存的物质是
A.亚硫酸 B.亚硫酸钠 C.硒化氢水溶液 D.硫黄
( )13、下列哪些事实是由于氯的非氧化性比硫强的结果
A.次氯酸的酸性比硫酸弱 B.氯能置换硫化氢中的硫
C.硫离子的还原性比氯离子强 D.硫能在空气中燃烧,而氯则不能21.
14、(1)某亚硫酸钠已部分被氧化成硫酸钠,经测定该混和物含硫25%,则混和物中亚硫酸钠与硫酸钠的物质的量之比为 .
(2)在FeSO4、Fe2(SO4)3、BaSO4、Al2(SO4)3的混和物中,氧元素含量的质量百分比为a%,则硫元素的质量分数为 Fe,Ba,Al三元素质量的总和占混和物的质量分数为 。
15、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比1:1组成的化合物,其他元素形成的单质(仍用a、b、c表示)和组成的化合物之间的反应关系如下(未配平)
Ⅰ、b + c→Y Ⅱ、a+c→Z Ⅲ、X+Y→m Ⅳ、X+Z→c+n Ⅴ、Y+Z→c+n
(1)上述反应中,最有充分理由说明该反应一定属于氧化还原反应的是
(2) 若m是无色粘稠油状液体化合物,则X、Y、Z的化学式分别是 、 、 。
(3)Ⅲ步反应的化学方程式是 。
(4)Ⅳ步反应的化学方程式是 。
16.某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数做了如下 实验:
取上述标准状况下的空气1L(内含N2、O2、SO2、CO2)慢慢通过足量溴水,然后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗净、干燥后称重为0.233g。请回答:
(1) 通入足量溴水的目的是:
(2)加入过量BaCl2溶液的目的是
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明:
(4)用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,证明:
(5)空气中,SO2的体积分数为 。(写清楚具体的计算过程,)
1.下列关于浓硫酸的性质的说法中,错误的是 ( )
A.浓硫酸的脱水性属物理性质,相应的变化过程是物理变化
B.蓝色石蕊试纸遇浓硫酸先变红后变黑
C.浓硫酸可吸收SO3
D.CuSO4·5H2O晶体投入到浓硫酸中,固体颜色由蓝变白
2.下列物质中,在化学实验时可用来提供100℃~200℃热浴的是 ( )
A.水 B.酒精 C.浓H2SO4 D.浓盐酸
3.锌钡白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是( )
A.ZnCO3和BaCl2 B.ZnS和BaSO4
C.ZnCl2和BaCO3 D.ZnCO3和Ba(NO3)2
4.某无色气体,可以使湿润的蓝色石蕊试纸变红,通入澄清石灰水中,石灰水变浑浊,接着又变澄清,将燃着的蜡烛放入盛有该气体的集气瓶中蜡烛熄灭,则该气体( )
A.一定是CO2 B.一定是SO2
C.可能是CO2或SO2 D.一定是CO2和SO2混和气体
5.检验某未知溶液中是否含有SO42-的下列操作中,最合理的是 ( )
A.加入硝酸酸化了的硝酸钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.加入盐酸酸化了的氯化钡溶液 D.先加盐酸酸化,再加氯化钡溶液
6.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
A.SO2、H2S、Cl2 B.SO2、O2、H2 C.HCl、HBr、HI D.SO2、CO2、O2
7.有一FeSO4、Fe2(SO4)3的混合物,经测定其中含硫质量分数为22.73%,则此混合物中 FeSO4与Fe2(SO4)3物质的量之比为 ( )
A.1:1 B.1:2 C.2:1 D.2:2
8.为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:①加水溶解;②加热蒸发结晶;③加入过量氯化钡溶液;④加入过量盐酸;⑤加入过量碳酸钾溶液;⑥过滤。下列操作顺序正确的是 ( )
A.①③⑤⑥④② B.①⑤③④⑥② C.①③④⑥⑤② D.①⑤③⑥④②
9.有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是 ( )
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定是BaSO4
D.此实验不能确定Na2SO3是否部分被氧化
10.A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①A、C均
能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C的氧化物可与强碱反应;④C、E在冷浓硫酸中发生钝化。由此可判断A、B、C、D、E依次为( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
11、为方便某些计算,有人将98%的浓H2SO4表示成下列形式,其中合理的是( )
A. H2SO4×![]() H2O B. H2SO4×H2O C. H2SO4×SO3
D. SO3×
H2O B. H2SO4×H2O C. H2SO4×SO3
D. SO3×![]() H2O
H2O
12、a克铜与足量的浓硫酸共热,完全反应产生标况下b升气体,则被还原的硫酸不可能是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13、Cl2和SO2皆可作漂白剂,混合使用后,其漂白效果会( )
A. 增强 B. 不变 C. 减弱 D. 难以确定
14、某元素的硫酸盐的分子量为a,同价态的该元素的碳酸盐的分子量为b,则该元素的化合价数值为-( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15、将绿矾晶体加热,除失去结晶水外,还发生下列反应 2FeSO4=Fe2O3+SO2↑+SO3↑
若将该反应的气体通入氯化钡溶液,则有(
)
A.硫酸钡沉淀 B.亚硫酸钡沉淀 C.SO3气体逸出 D.SO2气体逸出
16、下列关于实验室制取气体所用试剂的组合不合理的是( )
A.制Cl2: MnO2、HCl(浓) B.制H2:H2SO4(稀)、Zn
C.制O2: MnO2、H2O2 D.制CO2:H2SO4(稀)、CaCO3
17、在氯化钡溶液中通入SO2 ,溶液仍澄清,若将氯化钡溶液分装两只试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2 ,结果两试管中都有白色沉淀生成.由此得出下列结论合理的是( )
A.氯化钡有两性 B.两支试管中的白色沉淀都是BaSO4
C.SO2 具有还原性和酸性 D.升高PH值使SO2 水溶液中SO3 2- 浓度增大
18.下列实验事实或实验现象,反映了硫酸的哪些性质。
(1)在工业上可用铁制槽车或铝制槽车运输浓硫酸 。
(2)浓硫酸与甲酸共热可制备一氧化碳 。
(3)实验室用锌粒和稀H2SO4反应制备氢气 。
(4)浓硫酸露置在空气中质量增加 。
(5)浓硫酸和食盐反应可生成NaHSO4和Na2SO4两种盐 。
(6)浓硫酸和NaNO3反应可制备硝酸 。
19.硫酸最古老的生产方法是把绿矾(FeSO4·7H2O)装入反应器中加强热,会流出
油状液体,并有刺激性气味的气体放出,反应器中的固体变成红色,这个变化可以用两个化学方程式表示:
(1) 。
(2) 。
18、一种溶液里可能含有OH-、Cl-、CO![]() 、SO
、SO![]() 四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
(1)向第一支试管中滴入酚酞试液,溶液变红。(2)向第二支试管中加入Ba(NO3)2溶液,有白色沉淀生成。(3)向第三支试管中逐滴加入稀HNO3溶液,有无色气体生成,该气体能使澄清石灰水变浑浊;继续加入稀HNO3使溶液呈酸性时,再加入Ba(NO3)2溶液不产生沉淀。试判断:该溶液中肯定含有 离子,肯定没有 ,不能肯定的是 离子。
23.向铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到2.24L(标准状况)气体。过滤残留固体,干燥后称量,质量减轻了7.5g。求原硫酸的物质的量浓度。
硫和硫的化合物3
( )1、常温下能用铁罐或铝罐贮存的是
A.浓H2SO4 B.浓HCl C.稀H2SO4 D.稀HCl
( )2、下列各组离子在同一溶液中能够大量共存的是
A.Ba2+、Cl-、SO![]() 、NO3- B.Cu2+、K+、Cl-、S2-
、NO3- B.Cu2+、K+、Cl-、S2-
C.K+、H+、SO![]() 、S2- D.Cu2+、NO-3、SO
、S2- D.Cu2+、NO-3、SO![]() 、Cl-
、Cl-
( )3、下列关于氧族元素叙述错误的是
A.都能同氢气化合生成气态氢化物,其水溶液都显酸性 B.能跟大多数金属直接化合
C.原子的最外层都有6个电子,却彼此性质相似
D.单质的熔沸点及密度随核电荷数的增大而升高
( )4、某溶液中加入盐酸酸化的氯化钡溶液,无沉淀生成,当再加入硝酸钠时,有沉淀生成,则原溶液中可能含有的离子是
A.SO![]() B.S2- C.CO
B.S2- C.CO![]() D.SO
D.SO![]()
( )5、向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0.45摩 B.等于0.45摩 C.在0.45摩与0.90摩之间 D.大于0.90摩
( )6、科技文献经常出现的下列词汇,其中与相关物质的颜色并无联系的是
A.赤色海潮 B.白色污染 C.绿色食品 D.棕色烟气
( )7、燃放爆竹对环境的危害是
A.有毒有害气体、粉尘污染B.纸屑污染C.噪声D.前列三项总和
( )8.据各地报纸报道,在一些建筑工地的食堂里常发生将工业用盐当作食盐用,引起工人食 物中毒的现象,该工业用盐对人有致癌使用。这种盐中含有致癌作用物质的化学式是 A.MgCl2 B.KCl C.NaNO2 D.MgSO4
( )9、.你认为减少酸雨产生的途径可采取的措施是
①少用煤燃料 ②把工厂烟囱造高 ③燃料脱硫 ④已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
( )10、①农业生产中农药、化肥使用不当 ②生活中大量使用含磷洗涤剂 ③工业生产中 废气、废液、废渣排放不当 ④生活污水的任意排放 ⑤石油运输过程中因泄漏流
入江河 ⑥原子核反应的残留物随意排放。以上可以造成水污染的是
A.①③⑤⑥ B.①③④⑤ C.①②③⑥ D.全部都是
( )10、常见的大气污染分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下,发生变化所生成的新污染物。下列4种气体:①SO2,② NO,③NO2,④Cl2中,能导致二次污染的是
A.①②③④ B.只有①②④ C.只有②④ D.只有②
( )11、油井发生火灾,产生大量废气:①浓烟中的炭粒,②氮的氧化物,③碳的氧化物,④硫 的氧化物,⑤碳氢化合物,其中对大气造成污染并导致雨水酸化的有害气体是
A.①②③ B.②④ C.②③④ D.②④⑤
( )12、“漂尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2接触,SO2会部分被氧化成SO3,“漂尘”所起的主要作用是 A.氧化剂 B.还原剂 C.吸附剂 D.催化剂
( )13、“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝质易拉罐、铜导线等可以归为一类加以回收,它们属于
A.有机物 B.金属或合金 C.氧化物 D.盐
( )14、废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.外壳的金属材料还有再利用价值 B.防止电池中汞、镉、铝等对土壤和水源的污染
C.防止电池中渗漏的电解液腐蚀其他物品 D.回收其中的石墨和电解液
15、含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒杀鱼类。处理它的方法是用氧化法使其转化为低毒的氰酸钾(含CNO-),氧化剂常用次氯酸盐,且进一步可降解为无毒的气体。近期研究将把某些半导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应。但小粒的质量不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物有毒废物。
(1)二氧化钛在上述反应中的作用是 。
(2)氰化物经处理后产生的无毒气体应该是 和 。
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为
。
16. NO是大气污染物之一,目前,有一种治理方法是在400℃左右,在有催化剂存在的情况下,用氨把NO还原为N2和水,请写出该反应的化学方程式 。
17、已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:
5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4
(1)浓硫酸与木炭在加热条件下反应的化学方程式是 。
(2)试用下图所列各种装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序(按产生气体从左到右的方向)是 → → → 。(填装置的编号)
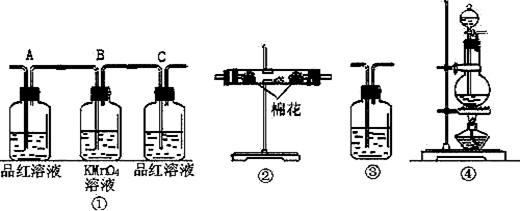
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(4)装置②所加的固体药品是 ,可验证的产物是 ,确立装置在整套装置中位置的理由是 。
(5)装置③中所盛溶液是 ,可验证的产物是
18、.取50毫升Na2CO3 和Na2SO4 的混和溶液,加入过量氯化钡溶液后得到 14.51克白色沉淀,用过稀硝酸处理后沉淀减少到4.66克,并有气体放出.试计算:
⑴原混和溶液中Na2CO3 和Na2SO4 的物质的量的浓度
⑵产生的气体在标准状况下的体积