高一化学期末模拟考试试题(二)
一、选择题(每小题只有一个选项符合题意)
1.下列燃料中,不属于化石燃料的是
A.煤 B.天然气 C.石油 D.氢气
2.下列物质中,分子数最多的是
A. 11.2升氢气(标准状况) B.16克液态氧
C. 6.02×1023个一氧化碳分子 D.2摩蔗糖
3.含有氯离子的物质是
A.氯水 B.液氯 C.氯酸钾溶液 D.氯气
4.在反应 2F2十2H20====4HF十O2 中,水是
A.还原剂 B.氧化剂 C.催化剂 D.脱氧剂
5.遇C12不会有颜色变化的是
A.湿润的蓝色石蕊试纸 B.湿润的淀粉碘化钾试纸
C湿润的红色布条 D.干燥的红色布条
6.一块金属钠,长期放在空气中,最终生成
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
7.下列变化加入氧化剂能发生的
![]()
![]() A.Cu2+ Cu B.C1— C12
A.Cu2+ Cu B.C1— C12
![]()
![]() C.H2SO4 SO2 D.CO2 CO32—
C.H2SO4 SO2 D.CO2 CO32—
8.标准状况下,1.6L N2含有m个分子,则阿伏加德罗常数为
A.14m B.28m C.m/28 D.7m
9.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后,Na2SO3转化为
A.Na2SO4 B.SO2 C.S D.Na2S
10.下列关于卤素化合物用途的叙述中错误的是
A.含氟牙膏能有效预防蛀牙
B.医疗上用饱和食盐水做生理盐水
C.溴化银可用于制胶卷和相纸
D.碘化银可用于人工降雨
11.欲除去氯气气体中混有的少量氯化氢,可将混合气体通过
A.饱和食盐水 B.氢氧化钠
C.灼热的铜网 D.浓硫酸
12.反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,若有0.3 mol HCl被氧化,则下列说法正确的是
A.有0.3 mol Cl2生成 B.有0.3 mol HCl参加反应
C.得到0.3 mol氧化产物 D.有0.3 mol电子发生转移
13.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.质量 B.密度 C.摩尔质量 D.分子数
14.“非典”期间,某同学将食盐溶解于水,通直流电电解(2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑),并将生成的Cl2与NaOH溶液反应得消毒液。该消毒液的有效成分是
2NaOH+H2↑+Cl2↑),并将生成的Cl2与NaOH溶液反应得消毒液。该消毒液的有效成分是
A.NaClO B.NaOH C.NaCl D.Cl2
15.下列各组离子中,在酸性溶液中能够大量共存,且通入Cl2后没有明显变化的是
A.K+,Na+,Cl-,I- B.Ca2+,Mg2+,HCO3-,NO3-
C.K+,Cu2+,SO42-,Cl- D.Ag+,Ba2+,NO3-,CO32-
16.下列离子方程式的书写正确的是
A.金属钠与水反应:Na+H2O=Na++OH-+H2↑
B.小苏打和烧碱在溶液中反应:
OH-+HCO3-=H2O+CO2↑
C.碘化钾溶液中加入少量溴水:2I-+Br2=I2+2Br-
D.用大理石与盐酸制取二氧化碳:
CO32-+2H+=H2O+CO2↑
17.按照Li、Na、K、Rb、Cs的顺序,下列叙述中错误的是
A.原子半径依次增大 B.单质还原性依次增强
C.单质熔点依次降低 D.单质密度依次减小
18.在两支试管中分别加入等物质的量的Na2CO3粉末和NaHCO3粉末,同时向两支试管中加入等体积、等物质的量浓度的稀盐酸(足量)。下列说法中正确的是
A.加Na2CO3粉末的试管中产生二氧化碳气体的速率快
B.两支试管中产生二氧化碳气体的速率一样快
C.两支试管中产生二氧化碳气体的体积一样大
D.加NaHCO3粉末的试管中产生二氧化碳气体的体积大
19.在50 g含有1.17 g氯化钠和0.84 g氟化钠的溶液中滴入过量的硝酸银溶液,充分搅拌、静置、过滤、洗涤、干燥,称量得到2.87 g固体。由此可得出的正确结论是
A.氯离子部分参加了反应 B.氟离子全部参加了反应
C.氟化银难溶于水 D.氟化银易溶于水
20.VLAl2(SO4)3溶液含Al3+ng,则溶液中SO42—的物质的量浓度是
![]()
![]()
![]()
![]()
21.设NA表示阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6L氧气含有n个O2,则NA为4n
B.常温常压下,1mol氦气含有的原子数为2NA
C.常温下,1mol氯气与足量的烧碱反应,转移的电子数为2 NA
D.18克水中所含的电子数为8 NA
 |
22.某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生找出以下原因,其中不会使溶液浓度偏低的是:
A.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
B.容量瓶刚用蒸馏水洗净,没有烘干
C.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
D.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
23.在x R2+ +y H+ +O2 = m R3+ +n H2O 的离子反应中,系数m的数值为
A.2x B.4 C.y /2 D.2
24.下列物质导电能力最差的是
A.固体钠 B.NaOH固体 C.盐酸 D.KNO3溶液
25.有15g A物质与10.5g B物质恰好完全反应,生成7.2gC物质、1.8g D物质和0.3mol E物质。则E物质的摩尔质量是
A.27.5g B.55g/mol C.100mol D.111g/mol
26.在反应8NH3+3Cl2 = 6NH4Cl+N2中,被氧化的氨与未被氧化的氨的物质的量之比为
A.8∶3 B.6∶1 C.3∶1 D.1∶3
二.填空题
27.向盛有硫酸铜和硫酸镁混合液的试管中投入一小块钠,反应结束后,可能沉于试管底部的固体物质是 ,该反应的化学方程式是:
。
28.为探究氯水中除H2O分子外还含有哪些粒子,某化学兴趣小组做了如下实验:
⑴观察氯水颜色,发现氯水呈黄绿色,说明氯水中肯定含有的粒子是(填化学式,下同)______________;
⑵取少量氯水于试管中,滴入硝酸酸化的AgNO3溶液,有白色沉淀生成,说明氯水中含有的粒子是___________;
⑶另取少量氯水于表面皿中,将一块蓝色石蕊试纸置于其中,发现试纸先变红然后褪色,说明氯水中含有的粒子是_________和_________;
⑷以上实验不能说明溶液中是否有____________存在;
⑸通过以上实验说明氯气与过量的水的反应是___________(填“完全”、“不完全”)的,因此氯气与水的反应是一个____________(填“可逆”、“不可逆”)反应,该反应的离子方程式是_________________________________________。
29.配制0.1mol/L盐酸溶液500ml,请按操作顺序〔(1)、(2)、(3)……〕填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法和数字。
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500ml),用玻璃棒搅拌,使其均匀混合。
( )待稀释的盐酸冷却后,沿玻璃棒注入500ml的容量瓶中。
( )用量筒量取密度为1.19g/cm3,质量分数为37%的浓盐酸约(取整数)____________ml注入烧杯中。
( )往容量瓶中小心加紧蒸馏水至液面接近刻度______cm处,改用_________加蒸馏水,使溶液_______________________恰好与刻度线水平相切。
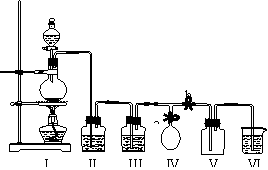
30.某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
⑴写出该反应的化学方程式并标出电子转移的方向和数目。
⑵装置Ⅲ中盛放的药品是_______,其作用是______。
⑶装置Ⅵ中盛放的药品是________,其作用是_______。
⑷实验开始后,______________________________(用“打开”或“关闭”等简洁的语言叙述对弹簧夹a和b的操作,下同);当集满一瓶氯气时,______________________,使氯气储存在气球中;换好集气瓶后,_______________________________,继续收集氯气。
31.某固体混合物可能由KNO3、K2SO4、CaCl2、NaCl、CuCl2、Na2CO3中的一种或几种组成,依次进行如下实验,观察到的实验现象记录如下:
①用干净的铂丝蘸取混合物在酒精灯火焰上灼烧,透过蓝色的钴玻璃,可以观察到火焰呈紫色;
②混合物加水得到无色溶液;
③向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀硝酸;
④向③的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此,可判断混合物中肯定含有 ,不能肯定是否含有 (均用化学式填写)。
32.向100ml、0.01mol/L的NaOH溶液中加入 g NaOH固体后,溶液中OH-离子浓度为0.1mol/L(不考虑溶液体积的变化),再吸收标准状况下 mL HCl气体后NaOH恰好完全转化为NaCl,发生的化学反应可用离子方程式表示为:
33.有A、B两种钠盐,各取适量混合,加入少量水后再强热生成气体C和残留固体D,C极易溶于水生成无色溶液E,将D或B溶于水后加入硝酸钡,生成不溶于稀硝酸的白色沉淀,E的浓溶液与二氧化锰共热生成黄绿色气体F。B溶于水显酸性。推断各物质的化学式:
A 、B 、C 、D 、F 。
34、有A、B、C、D、E五种无色溶液,只知它们是NaHCO3、K2CO3、NaOH、HCl、Ca(HCO3)2溶液,为了鉴别它们,各取少量进行如下实验:
①A与B混合无明显现象。
②B与C或D混合均有气体产生。
③D与A或E混合均有沉淀生成。
根据以上实验,推知A是________,B是___________,C是__________,D是___________,E是__________。
三.计算题
35.将标准状况下13.44 L氯化氢气体溶解于水后配成50.0 mL溶液,得到密度为1.19 g·cm-3的盐酸。试计算:
⑴所得盐酸的物质的量浓度。
⑵该盐酸中溶质的质量分数。
36.在1.00 L 1.00 mol·L-1 NaOH溶液中通入16.8 L标准状况下的CO2。
⑴计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
⑵将上述溶液蒸干、灼烧,可以得到Na2CO3多少克?
37.将15.6g Na2O2完全溶于适量的水中将产生(标准状况)氧气体积?再将所得溶液加水稀释为500mL,推算该500mL溶液物质的量浓度。
38.标况下,一个装满Cl2的容器为74.6g,若装满N2,则质量为66g,则此容器的容积为多少升?