高一化学期末模拟考试试题(一)
一、选择题:(每小题只有一个答案29*2=58分)
1、某元素在化学反应中,由化合态变为游离态,则该元素
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原 D.化合价一定升高
2、下列说法不正确的是(N0表示阿佛伽德罗常数)
A.活泼金属从盐酸中置换出1摩H2,发生转移的电子数为2N0
B.在常温常压下,0.1 mol Ne含有的原子数为N0;
C.71 g Cl2所含原子数为2N0
D.在常温常压下,11.2 L N2含有的分子数为0.5N0
3、标况下a个氢气分子的质量为b克,则阿佛加德罗常可表示
A.a/2b B.b/2a C.2a/b D.2b/a
4、下列说法不正确的是
A.Cl2有毒,氯离子无毒
B.氯原子既有氧化性又有还原性,氯离子只有还原性
C.氯原子与氯离子具有相同的核外电子数
D.氯离子比氯原子稳定
5、自来水可以用氯气消毒,某学生用这种自来水去配制下列物质的溶液时,不会造成该物质变化的是
A. Ag(NO3) B.NaOH C. Ca(OH)2 D.CuCl2
6、潮湿的氯气,新制的氯水,漂白粉的水溶液均能使有色布条褪色,是因为它们均含有:
A.氯气 B.次氯酸 C.次氯酸根 D.氯离子
7、除去氯气中水蒸气,所用的干燥剂是
A.固体烧碱 B.生石灰 C.浓硫酸 D.饱和食盐水
8、下列物质中含有自由移动的Cl-的是
A.盐酸 B.液态氯化氢
C.NaCl晶体 D.KClO3溶液
9、今有盐酸、氯化钠、氢氧化钠、氯水四种无色溶液,用下列哪种试剂(纸)可将它们一次性鉴别开来
A.Na2CO3试液 B.硝酸银溶液
C.紫色石蕊试纸 D.酚酞试液
10、下列物质长期露置在空气中,不考虑水的蒸发,质量增大的是
A.纯碱晶体 B.浓硫酸 C.浓盐酸 D.氯水
11、分别由下列四组物质制取气体:①浓盐酸与MnO2 ②KClO3与MnO2 ③NaCl与浓硫酸④CaCO3 与稀盐酸,所产生的气体在相同条件下的密度,由小到大的排列顺序为
A.①<③<④<② B.②<③<④<①
C.④<③<②<① D.②<③<①<④
12、实验室制取下列各组气体,所用发生装置相同的是
A.HCl与Cl2 B.H2 与HCl C.O2 与H2 D.HCl与O2
13、已知 2Fe2++Cl2=2Fe3++2Cl-,2Fe3++Cu=2Fe2++Cu2+,Fe+Cu2+=Fe2++Cu可判断下列微粒的氧化性强弱顺序正确的是
A.Fe2+>Cu2+ >Fe3+>Cl2 B.Fe3+>Cl2 > Fe2+>Cu2+
C.Cl2 > Fe3+>Cu2+ > Fe2+ D.Cl2 > Fe3+ > Fe2+>Cu2+
14、下列反应中水作氧化剂的是
A.Cl2+H2O=HCl+HClO
B.2 F2+2H2O=4HF+O2
C.2Na+2H2O=2NaOH+H2 ↑
D.3NO2+H2O=4HNO3+NO
15、在 3Cl2+6NaOH =5NaCl+NaClO3+3H2O 反应中,被氧化物质与被还原物质的分子数之比为
A.1:2 B. 1:5 C.5:1 D.2:1
16、今有H2与CO的混和气体V升,当其完全燃烧时,所需氧气的体积为V/2升,则原混和气体中CO与H2的体积比是:
A.1:1 B.2:1 C.1:2 D.任意比
17、用胆矾(CuSO4·5H2O)配制0.1摩/升的硫酸铜溶液,正确的操作是
A、将胆矾加热除去结晶水后,再称取16克溶解在1升水里;
B、称25克胆矾,溶解在1升水中
C、称25克胆矾溶于水,然后将此溶液稀释至1升; D、将16克胆矾溶于水,然后将此溶液稀释至1升
18、用准确称量的氯化钠固体配制1.00摩/升NaCl溶液时,不需要用到的仪器是:
A.分液漏斗 B.容量瓶 C.烧杯 D.胶头滴管
19、在某Na2SO4和Fe2(SO4)3的混合物中,Fe3+的物质的量浓度为0.1摩/升, SO42- 的物质的量浓度为0.3摩/升,则Na+的物质的量浓度为:
A.0.6摩/升 B.0.3摩/升 C.0.2摩/升 D.0.15摩/升
20、与50毫升1摩/升的MgCl2溶液中的Cl-物质的量浓度相等的溶液是
A. 150毫升1摩/升NaCl溶液
B. 75毫升2摩/升NH4Cl溶液
C. 150毫升3摩/升KCl溶液
D. 75毫升1摩/升AlCl3溶液
21、配制一定物质的量浓度的溶液,造成浓度偏高的操作是
A.洗烧杯和玻棒的溶液转入容量瓶
B.容量瓶内有水
C.定容时,眼睛仰视刻度线
D.溶解后的溶液未冷却至室温就转入容量瓶中
22、用10毫升0.1摩/升BaCl2溶液恰好可使同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的SO42-完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是:
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
23、下列离子方程式正确的是
A.Ba(OH)2溶液与稀硫酸混和:
Ba2++SO42-=BaSO4
B.BaCO3与稀硫酸混和:
BaCO3+2H+=Ba2++CO2↑+H2O
C.铝与稀硫酸混和:Al+2H+=Al3++H2↑
D.用NaOH溶液吸收Cl2:
Cl2+2OH-=Cl-+ClO-+H2O
24、在无色酸性溶液中能大量共存的离子组是
A.Na+, ClO-,K+,NO3-
B.K+,OH-,CO32-,Cl-
C.Na+, SO42-, NO3-,NH4+
D.K+,MnO4-,Na+, SO42-
25、每次焰色反应的实验以前,都需用试剂洗涤铂丝,该试剂是
A.酒精 B.稀盐酸 C.稀硫酸 D.蒸馏水
26、将金属钠投到盐酸中,下列说法正确的是
A.一定先和水反应 B.若酸稀则先与水反应
C.一定先和酸反应 D.与盐酸、水的反应同时发生
27、在天平的两个托盘上各放一个盛100毫升0.01摩/升的盐酸的烧杯,天平平衡,若在一个烧杯中加0.3克钠,另一个烧杯中加0.3克镁,反应完全后,天平两端
A.仍平衡 B.加镁的一端下降
C.加钠的一端下降 D.无法判断
38、在甲、乙、丙、丁四个烧杯内分别放入物质的量均为0.07摩的钠,氧化钠,过氧化钠和氢氧化钠,然后各加入100毫升水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶解的质量百分比浓度大小须序是
A.甲<乙<丙<丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
29、用下列物质:①500毫升1摩/升NH3·H2O溶液;②50毫升1摩/升NaOH溶液 ; ③ 20毫升1摩/升HCl溶液;④15毫升1摩/升H2SO4溶液,进行导电性实验,观察灯泡的明暗程度,灯泡最暗的是:
A.① B.② C.③ D.④
二、填空题:(27分)
30、氢氧化钠和碳酸氢钠的固体混合物在一个固定体积的密闭容器中加热,使充分反应,结果放出二氧化碳气体V1L(V1≠0),再在所得残渣中加入足量的盐酸溶液,又放出二氧化碳气体V2L,回答下列问题:
⑴所得固体物质是: ;
⑵氢氧化钠和碳酸氢钠总物质的量:______________;
⑶氢氧化钠和碳酸氢钠的物质的量之比是:__________.
31、配制一定物质的量浓度的溶液,先要检查容量瓶是否漏水,其方法:是_________________________________
__________________________________________,
容量瓶上需标有刻度线 、 等。
32、在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中, 元素的化合价升高, 电子,发生 反应,故 是还原剂,从生成物分析,氧化产物为 还原产物为 电子转移数目为 e。还原产物与氧化产物的物质的量之比为 。
33、新制氯水含有多种成分,现分别做如下实验:
(1)将氯水滴到无水硫酸铜上,晶体呈蓝色,说明有 。
(2)闻一下氯水气味,并观察其颜色为浅黄绿色,说明有 。
(3)将紫色石蕊试液滴入氯水中,先变红后褪色,说明有 。
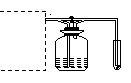 34、如图,A处通入Cl2,关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色,回答:
34、如图,A处通入Cl2,关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色,回答:
(1)写出制Cl2的化学方程式:
___________________________________________
(2)在方框内补画Cl2的发生装置
(3)D中溶液可能是:______
(A)浓硫酸 (B)饱和食盐水
(C)烧碱溶液 (D)水
三、计算题:(15分)
35、将一块表面被氧化成Na2O的钠 5.22 克投入到94.78克水中,待完全反应后,收集到氢气0.1摩,
求:(1)金属钠表面有多少克Na2O;
(2)所得溶液的百分比浓度。
36、碳酸钠和碳酸氢钠的固体混合物19克,加热,使充分反应,所得固体物质的质量为15.9克,并放出二氧化碳气体,在所得固体物质中加入0.1L盐酸溶液,又放出二氧化碳气体(不考虑盐酸的挥发),所得溶液呈酸性,在所得溶液中加入2L 0.53mol/lNaOH 溶液,所得溶液呈现中性。
试算:
⑴反应中共产生标况下的二氧化碳的体积;
⑵所加入盐酸溶液的物质的量浓度;
⑶如用该盐酸溶液和二氧化锰反应制取氯气,反应中产生氯气2.24L(标况),
计算
①反应中被氧化的盐酸的物质的量
②反应后氯离子的物质的量浓度(复略溶液体积变化)
③反应所得溶液中加入足量硝酸银溶液所得沉淀的质量