![]()
|
|
学科: 化学 |
| 教学内容:高一化学期末综合测试题 |
【同步达纲练习】
一、选择题
1.下列微粒还原性最强的是( )
A.Cl- B.Cl2 C.HI D.I2
2.下列物质能导电且属于强电解质的是( )
A.氯水 B.蔗糖 C.液氯 D.熔融NaOH
3.鉴别Cl-、Br-、I-可以选用的试剂是( )
A.碘水、淀粉溶液 B.溴水、汽油
C.淀粉、KI溶液 D.AgNO3溶液、稀HNO3
4.下列溶液中c(Cl-)与50mL1mol/L的AlCl3溶液中c(Cl-)相等的是( )
A.100mL1mol/LNaCl溶液 B.150mL2mol/LCaCl2溶液
C.200mL3mol/LKCl溶液 D.100mL3mol/LFeCl3溶液
5.下列变化中,既是化合反应,又是氧化还原反应的是( )
A.Zn与浓盐酸反应 B.CO和O2反应
C.Na2O2和H2O反应 D.Na2O溶于水
6.下列叙述错误的是( )
A.同温同压下,任何气体的密度之比,等于它们的相对分子质量之比
B.同温、同压下,任何混合气体与任何一种纯净气体,如果体积相同,所含分子数也相等.
C.同温同压下,任何气体的体积比,等于它们的分子数之比.
D.同温同压下,同体积的任何气体其摩尔质量相同.
7.配制1.0mol/L的NaCl溶液500mL在下列仪器中需要用到的是①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤漏斗 ⑥500mL容量瓶 ⑦药匙 ⑧250mL容量瓶 ⑨胶头滴管 ⑩坩埚( )
A.①③④⑥⑨⑩ B.①④⑦⑧⑨⑩
C.①③④⑥⑦⑨ D.①②④⑤⑦⑨
8.从能量角度分析火碱与盐酸混合,其反应为( )
A.中和反应 B.吸热反应 C.放热反应 D.复分解反应
二、选择题.
9.下列化学反应的离子方程式正确的是( )
A.Ba(OH)2溶液中加稀H2SO4 Ba2++SO42-=BaSO4↓
B.K与冷水反应 2K+2H2O=2K++2OH-+H2↑
C.向石灰水中通过量的CO2 OH-+CO2=HCO3-
D.磷酸钙跟盐酸反应 PO43-+3H+=H3PO4
10.根据反应①2Fe2++Cl2=2Fe3++2Cl- ②HClO+H++Cl-=H2O+Cl2 ③2Fe3++Cu=2Fe2++Cu2+ ④Fe+Cu2+=Fe2++Cu判断有关粒子氧化性由强到弱排列顺序正确的是( )
A.Fe3+>Cl2>Cu2+>HClO>Fe2+ B.Cl2>Fe3+>HClO>Cu2+>Fe2+
C.HClO>Cl2>Fe3+>Cu2+>Fe2+ D.Cl2>HClO>Fe3+>Cu2+>Fe2+
11.除去食盐中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,加入下列试剂的顺序正确的是( )
A.Na2CO3、BaCl2、NaOH、HCL B.HCl、BaCl2、Na2CO3、NaOH
C.BaCl2、NaOH、Na2CO3、HCl D.NaOH、Na2CO3、BaCl2、HCl
12.一块表面被氧化生成Na2O的金属Na的质量10.8g投入100g水中放出0.1molH2则被氧化的钠的质量为( )
A.4.6g B.6.2g C.7.8g D.9.2g
13.下列金属氯化物中,不能由盐酸和金属直接反应得到的是( )
A.ZnCl2 B.FeCl3 C.NaCl D.CuCl2
14.向一定浓度的下列物质的澄清溶液中通入过量的CO2气体最后肯定没有沉淀生成的是( )
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2
A.③ B.①③④ C.①②③ D.①②③④
15.下列各组离子在同一溶液中可以大量共存、当加入NaOH溶液时有沉淀析出,当加入盐酸时有气体产生的是( )
A.Na+、Mg2+、SO42-、Cl- B.Mg2+、K+、NO3-、SO42-
C.Ba2+、Na+、CO32-、Cl- D.Ca2+、Na+、Cl-、HCO3-
16.若NA表示阿伏加德罗常数,下列说法正确的是( )
A.在标况下,NA个水分子所占体积约为22.4L
B.5.6g铁与Cl2完全反应失去电子的数目为0.3NA
C.1molCl2发生化学反应,转移的电子数必为2NA
D.CH4的摩尔质量与NA个CH4分子的质量在数值上相等
17.在标况下有H2、Cl2的混合气体aL经光照完全反应后所得气体恰好能使bmolNaOH完全转化为盐.a与b的关系不可能( )
A.b=![]() B.b≥
B.b≥![]() C.b>
C.b>![]() D.b<
D.b<![]()
18.将充入一定量干燥空气的烧瓶再充满HCl后演示喷泉实验,实验结束后的溶液中HCl的物质的量浓度为( )
A.0.045mol·L-1 B.0.45mol·L-1
C.0.029mol·L-1 D.缺乏数据,无法计算
19.已知VmLAl2(SO4)3溶液中含a克Al3+,现取![]() 该溶液并将其稀释至4VmL.则稀释后的溶液中SO42-的物质的量浓度是( )
该溶液并将其稀释至4VmL.则稀释后的溶液中SO42-的物质的量浓度是( )
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1 C.
mol·L-1 C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
20.新制的CO2中常混有少量O2、H2S、HCl、H2O四种气体杂质.可选用①浓H2SO4 ②红热的铜丝网 ③CuSO4溶液 ④饱和NaHCO3溶液等除去其中的杂质从而得到纯净的CO2,下列操作顺序正确的是( )
A.④③①② B.④②①③ C.③④①② D.④②③①
三、填空题
21.有一瓶混有NaCl的NaOH固体试剂,为了测定NaOH的纯度,某生用浓度为0.2mol·L-1的标准盐酸进行测定.请回答下列问题:
(1)用托盘天平称量5.0g固体试剂,经以下步骤配制溶液:①用适量蒸馏水将所称药品溶解在烧杯中,并振荡 ②随后立即直接转移到500mL容量瓶中 ③直接倾倒蒸馏水恰好至刻度线,则配制成待测液备用.以上步骤中,各步均有明显错误,请指出并改正:
①
②
③
22.实验室用下列有关装置先制取干燥、纯净的Cl2,然后进行有关性质实验,试根据下列有关装置回答有关问题:
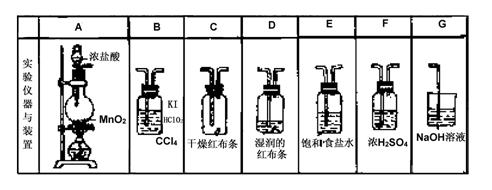
(1)上述装置中各仪器从左到右的连接顺序为 ;
(2)A装置中制得Cl2中所含的杂质气体为 ;E装置的作用是 ;D装置中的现象为 .
(3)写出下列反应的化学反应方程式
①A装置中: ;
②B装置中: ;
③G装置中: 。
四、本题3个小题,共11分
23.新制的氯水中含有溶质的粒子(化学式表示) 取新制的氯水三份、第一份滴加AgNO3溶液现象是 反应的离子方程式 第二份滴加紫色石蕊试液并振荡其现象是 其理由 第三份滴加淀粉KI的混合溶液现象是 化学方程式 .
24.23.4gNa2X中含有0.300molX2-则Na2X的摩尔质量为 X的相对原子质量为 .
25.已知:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,E是我们日常生活中做菜必不可少的调味品,请根据图示转化关系,完成下列各题:
2NaOH+Cl2↑+H2↑,E是我们日常生活中做菜必不可少的调味品,请根据图示转化关系,完成下列各题:
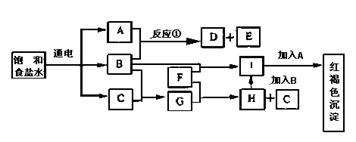
(1)写出下列代号所示物质的化学式:
A 、B 、C 、G 、I
D 、E 、F 、H 、J
(2)写出电解饱和食盐水的离子方程式 .
(3)鉴定某纯净物质是E的方法是 .

参考答案:
【同步达纲练习】
一、1.C 2.D 3.D 4.C 5.B 6.D 7.C 8.C
二、9.BC 10.C 11.C 12.A 13.BD 14.B 15.D 16.BD 17.B 18.A 19.C 20.AC
三、21.①固体溶在烧杯中不应振荡,应用玻璃棒搅拌.②不能将液体立即注入容量瓶,应将液体冷却至室温后再注入容量瓶. ③不能直接倾倒蒸馏水至刻度线,应在液体离刻度线1-2cm处时改用胶头滴定管加至刻度线.
22.(1)AEFCDBG;(2)HCl和H2O;除Cl2混杂的HCl气体;红色布条褪色;
(3)①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②2KI+Cl2=2KCl+I2 ③2NaOH+Cl2=NaCl+NaClO+H2O
23.Cl2、HClO、H+、Cl-、ClO-、OH-等;白色沉淀;Ag++Cl-=AgCl↓先变红色,后褪色;溶液中含H+石蕊变红,HClO具有漂白性,又使红色褪去;变蓝;2KI+Cl2=2KCl+I2.
24.78g·mol-1;32
25.(1)A:NaOH B:Cl2 C:H2 D:NaClO E:NaCl F:Fe G:HCl H:FeCl2 I:FeCl3 J:Fe(OH)3
(2)2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
