高一化学期中复习练习
姓名 学号 得分
一、选择题(每小题只有一个选项符合题意。)
( )1. 科学家把不同原子核称为不同核素。我国科学家在世界上首次合成了三种新核素,其中一种新核素的名称是铪-185,符号185Hf,下列关于铪-185的叙述,不正确的是A、它是一种新的原子 B、它是一种新的元素
C、它的质量数为185 D、它是铪-180的一种新的同位素
( )2. Na和Na+两种粒子中,不相同的是
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数
A、①② B、②③ C、③④ D、②③④
( )3. 某微粒用![]() 表示,下列关于该微粒的叙述正确的是
表示,下列关于该微粒的叙述正确的是
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.质量数=Z+A
( )4。下列用电子式表示物质形成过程正确的是
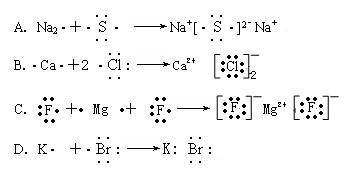 |
( )5。已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式中正确的是
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
( ) 6.下列排列顺序错误的是
A.非金属性 As>S>Cl>F B.金属性 Rb>K>Mg>Al
C.稳定性 AsH3<PH3<H2S<HF D.半径 Na>P>O>F
( )7.短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列正确的是
A.原子半径A<B<C B.A的氢化物的稳定性小于C的氢化物
C.B的氧化物的熔点比A氧化物高 D.A与C可形成离子化合物
( )8.元素X的最高正价和最低负价的绝对值之差为6,Y元素的离子与X元素的离子具有相同的电子层结构,则X、Y形成的化合物可能是
A.MgF2 B.K2S C.NaCl D.KCl
( )9.对于A2 + 3B2![]() 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A、v(B2) =0.8mol/(L•s); B、v(A2) =0.4mol/(L•s);
C、v(C) =0.6mol/(L•s); D、v(B2) =4.2mol/(L•min)。
( )10.既有离子键又有共价键的化合物是
A.Na2O B.MgCl2 C.NaOH D.NH3
( )11 当两个原子形成共价键时,原子的能量将
A、 升高 B、降低 C、保持不变 D、一个升高,一个降低,但总能量不变
( ) 12 下列反应属于放热反应的是
A、铁与盐酸反应 B、C与CO2共热到高温
C、碳酸钙分解 D、八水氢氧化钡晶体与氯化铵固体反应
( )13一个原电池的总反应的离子方程式是Fe+Cu2+=Fe2++Cu,该反应的原电池的正确组成是
| 正极 | 负极 | 电解质溶液 | |
| A | Fe | Cu | CuCl2 |
| B | Cu | Zn | H2SO4 |
| C | Cu | Fe | CuSO4 |
| D | Zn | Fe | CuCl2 |
二、选择题(每小题有一个或两个选项符合题意。)
( )14.一定条件下,可逆反应2A![]() B+3C,在下列四种状态中处于平衡的是
B+3C,在下列四种状态中处于平衡的是
正反应速率 逆反应速率
A. νA=2mol/L·min νB=2mol/L·min
B. νA=2mol/L·min νC=2mol/L·min
C. νA=1mol/L·min νB=2mol/L·min
D. νA=1mol/L·min νC=1.5mol/L·min
( )15.下列说法正确的是
A. 在共价化合物中不可能含有离子键
B. 阴阳离子之间通过静电引力形成的化学键,叫离子键
C. 含有共价键的化合物一定是共价化合物 D. 含有离子键的化合物不一定是离子化合物
( )16.下列说法中不正确的是
A. 化学反应都伴随能量变化 B. 化学反应中的能量变化都表现为热量变化
C. 反应物的总能量高于生成物的总能量时,反应释放能量
D. 若化学键形成时释放的总能量大于破坏化学键所吸收的总能量,反应释放能量
( )17.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是
A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
B.将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
( )18.某元素原子的最外层只有2个电子,则该元素
(A)一定是ⅡA族元素 (B)—定是金属元素
(C)一定是正二价元素 (D)可能是金属元素,也可能不是金属元素
( )19 有a、b、c、d四种元素。a、b的阳离子与c、d的阴离子具有相同的电子层结构;a的阳离子的正电荷数小于b的阳离子的正电荷数,c的阴离子的负电荷数大于d的阴离子的负电荷数。则它们的离子半径的关系是
(A)a>b>c>d (B)b>a>d>c
(C)c>a>d>b (D)c>d>a>b
( )20,(04全国理综)某温度下在密闭容器中发生如下反应:
![]()
![]() 2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为
2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为
A.20% B.40% C.60% D.80%
( ) 21。
(04年北京理综)在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气) ![]() 2HI(气)。 已知H2和I2的起始浓度均为0.10mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是
A.0.16 B.0.08 C.0.04 D.0.02
2HI(气)。 已知H2和I2的起始浓度均为0.10mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是
A.0.16 B.0.08 C.0.04 D.0.02
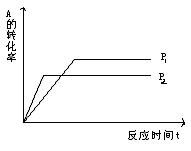
( )22。反应mA(g)+nB(g) ![]() pC(g)+qD(g),在温度相同、压强不同时A的转化率与反应时间的关系如图所示,下列关系正确的是( )
pC(g)+qD(g),在温度相同、压强不同时A的转化率与反应时间的关系如图所示,下列关系正确的是( )
A.p1>p2 B.p1<p2 C.n+m>p+q D.n+m<p+q
三、(填空题)
23、从化学键的角度看,化学反应的过程,实质上就是旧化学键的断裂和新化学键的形成,在这个过程中,破坏反应物中的旧化学键需要___ ____能量(设其值为E1),形成新的化学键需要___ _ __能量(设其值为E2),若E1>E2,则该反应___ ____能量,若E1<E2,则该反应___ __ __能量。
24、在铜片、锌片、稀硫酸构成的原电池中,负极为_______,该极上发生____ _反应,方程式为_____________________ ____;正极为_______,该极上发生___ __反应,方程式为______________________ ___。
25 一个5.0L的容器中,盛入8.0mol某气态物质R,5min后,测定R的浓度还剩余0.4mol/L,这种反应物的化学反应速率为___________ mol/(L·S)。
26 在短周期元素中:
(1) 金属性最强的元素是____________
(2) 单质与水反应最剧烈的非金属元素是____写出该单质与水反应的化学方程式___ ___ _
(3) 地壳中含量最丰富的元素位于第____周期第________族;地壳中含量最丰富的金属元素位于第____周期第________族
27. 短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X、Y、Z元素的名称及符号:X________Y___________Z__________
(2) 用电子式表示ZX2的形成过程
__________________________________________
(3)Y2X对应水化物的电子式______________,其中存在的化学键有______________。
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式
__________________________________________________________________。
28.有X、Y、Z三种短周期元素,X的气态氢化物的化学式为H2X,此气态氢化物分子中含有质子数为10,X原子核内质子数与中子数相等,Y与X可以形成离子化合物YX,Y阳离子的电子层结构与Ne相同,Z与Y同周期,其气态单质黄绿色的有刺激性气味气体,试回答:
1、写出各元素符号:X_______,Y_______,Z_______。
3、Y单质与Zn同时浸泡在稀硫酸中形成原电池,并用电流表测试电流的方向,Zn是_____极,电子从_____极流向_____金属(写元素符号),电流从______金属流向______极。
29.恒温下,将xmol N2与ymol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)
⑴若反应某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,则x =______________。
⑵反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)
为25%,平衡时NH3的物质的量_____________。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
n(始)∶n(平) = __ _ 。
⑷原混合气体中,x∶y= ________ 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= ________ 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = ___________ 。
30、由铁片、铜片和200mL 1mol/L的FeCl3溶液组成的原电池,
电极反应总式:Fe + 2Fe3+ = 3Fe2+
若铁片只发生电化学腐蚀,则当连接铜片和铁片的导线在500S中通过了0.1mol电子时。
(1) 计算消耗了铁片的质量
(2) 计算在这500S内FeCl3的平均反应速率。