高一化学期中考试试题4
相对原子质量:Na—23, H—1, O—16, S—32, C—12,Cl—35.5, K—39,Mn--55
一.选择题:
(每小题只有一个选项符合题意 ,请把正确答案涂在答题卡上。每小题2分,共10分。)
1.下列说法正确的是
A.锂保存在石蜡油中 B.钠保存在汽油中
C. 钾保存在CCl4中 D.铯保存在水中
2.下列物质属于强电解质的是
A. 醋 酸 B.蔗糖 C.Cu D.NaC1
3.下列氢氧化物中,碱性最强的是
A、KOH B、LiOH C、NaOH D、CsOH
4.下列说法中正确的是:
A、吸热反应一定是反应物的总能量高于生成物的总能量
B、是放热反应中的反应物都可作为燃料能源
C、要使燃料充分燃烧,只要是温度达到着火点和有O2参加
D、不仅仅只有化学反应才伴随着能量变化,物理变化中也有能量变化
5.将2.3g钠投入97.7g水中,所得溶液质量分数是
A、等于2.3% B、等于4% C、小于2.3% D、大于4%
二、选择题(每小题有1—2个选项符合题意,每题2分,共26分。)
6.下列反应中,水只作为氧化剂的是
A、2F2+2H2O==4HF+O2 B、Cl2+H2O==HCl+HClO
C、2Na+2H2O==2NaOH+H2↑ D、![]()
7.在强酸性溶液,下列离子组能大量共存且溶液为无色透明的是
A、Na+ K+ OH- Cl- B、Na+ Cu2+ SO42- NO3-
C、Mg2+ Na+ SO42- Cl- D、Ba2+ HCO3- NO3- K+
8.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X 2+与单质R不反应;X 2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性强弱符合
A R2+>X2+>Z2+>Y2+ B X2+>R2+>Y2+>Z 2+
C Y 2+>Z 2+>R 2+>X 2+ D Z 2+>X2+>R 2+>Y2+
9.下列反应的离子方程式不正确的是
A、在Na2CO3溶液逐渐滴入少量的稀盐酸:CO32-+2H+==H2O+CO2↑
B、Na2O2与水反应:2Na2O2+2H2O==4Na++4OH-+O2↑
C、向Ba(OH)2溶液中滴加KHSO4溶液至中性:
Ba2++2OH-+2H++SO42- ==BaSO4↓+2H2O
D、CaCO3与稀HCl反应制备CO2:CO32-+2H+==H2O+CO2↑
10.关于下列反应及其叙述中,正确的是
A、MnO2、Na2O2、H2O2都是过氧化物
B、NaH+H2O==NaOH+H2↑氢气既是氧化产物,又是还原产物
C、2Na2O2+2CO2==2Na2CO3+O2 该反应转移的电子总数为4e-
D、Na2O2与水反应中,Na2O2是氧化剂,H2O是还原剂
11.下列比较不正确的是
A.熔点Li>Na>K B.还原性K>Na>Li
C.氧化性Cs+>Rb+>K+ D.密度Li>Na>K
12.二氧化碳气体含有少量氯化氢(HCl),若要除去HCl,最好选用下列那种溶液:
A、氨水 B、浓硫酸 C、饱和碳酸氢钠溶液 D、饱和石灰水
13.用光洁的铂丝蘸取某无色溶液,在无色灯焰上灼烧,观察到黄色火焰,则下列有关该无色溶液的叙述正确的是:
A、只含有Na+ B、一定含有Na+和K+
C、可能含Na+或K+的一种 D、一定含Na+,也可能含K+
14. 等质量的SO2和SO3
A、所含氧原子的个数比为2:3 B、所含硫原子的个数比为1:1
C、所含氧元素的质量比为5:6 D、所含硫元素的质量比为5:4
15.下列说法中,正确的是:
A、1molO的质量是32g/mol B、OH-的摩尔质量是17g
C、1mol H2O的质量是18g/mol D、CO2的摩尔质量是44g/mol
16.在3Cl2+8NH3==6NH4Cl+N2的反应中,被氧化的氨与未被氧化的氨分子质量之比为
A、1 :6 B、1 :3 C、3 :1 D、6 :1
17.将一块金属钾投入到刚刚制得的FeCl3溶液中,反应的生成物是:
A. Fe和 KCl B.H 2 和 KOH
C. KCl 和O2 、Fe(OH )3 D. KCl 、H 2 和 Fe(OH)3
18.在泡沫橡胶的制造中,要利用下列反应放出氧气:2H2O2=2H2O+O2↑,其中,H2O2:
A、是氧化剂 B、是还原剂
C、既是氧化剂,又是还原剂 D、既不是氧化剂,又不是还原
三、选择题(每小题只有1个选项符合题意,每小题3分,共15分)
19.下列反应既属于氧化还原反应,又属于吸热反应的是
A 、铝片与稀盐酸反应 B、Ba(OH)2·8H2O与NH4Cl的反应
C 、灼热的碳与CO2的反应 D、甲烷在氧气中的燃烧反应
20.被称为万能还原剂的NaBH4和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A NaBH4既是氧化剂又是还原剂
B NaBH4是氧化剂,H2O是还原剂
C 硼元素被氧化,氢元素被还原
D 被氧化的元素与被还原的元素质量比为1 :2
21.将CO和H2混合气体3克和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na 2O 2,则固体增重的质量为
A、1.5克 B、3克 C、6克 D、无法计算
22.已知在水溶液中进行的两个反应:2X—+ Z2 === 2Z —+X2 ;
2W — +X 2 === 2X—+W2 ;均从左向右进行,则反应:
W2+ 2Z — === Z 2 +2W— 进行的方向是:
A.从左向右。 B.从右向左。 C. 不能进行 D.无法判断
23.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(反应方程式18题)为原料制取氧气,当制得相同物质的量的氧气时,三个反应中需要反 应物的物质的量之比为
A 1 :1 :1 B 1 :3 :1 C 3 :1 :3 D 6 :3 :2
四、填空题(5题共41分,请将答案直接填写在空格处)
24.(12分)观察刚切开的金属钠断面呈光亮银白色,在空气中放置,断面很快变暗,这是因为生成了 物质;以后渐渐变成白色固体,这是因为生成了 ,在潮湿空气中,白色固体很快变成溶液,这是因为发生了 现象,再过一段时间,液体物质又变成白色粉末,这是因为生成了 物质,最后将白色粉末与盐酸反应,发现有气体生成,写出上述变化的有关化学方程式。
(1) (2)
(3) (4)
25.(12分)右图表示A--E五种物质的相互
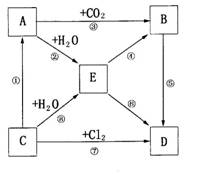 转化关系,其中A为淡黄色粉末,C为单质,
转化关系,其中A为淡黄色粉末,C为单质,
D为离子化合物。
⑴推断A为 。B为 。
C为 。D为 .
⑵写出③、⑤、⑧的化学反应方程式,
若为氧化还原反应还要标出电子转移
的方向和数目,指出氧化剂、还原剂。
③
⑤
⑧
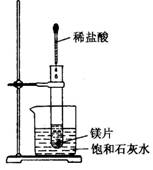
26.(5分)如右图示,25℃时,把试管放入盛有少量 饱和石灰水的烧杯中,试管中开始放入镁片,再用滴 管滴入5ml盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象:
①
②
(2)产生上述现象的原因是
① 。
②
。
(3)由实验推知,Mg与HCl反应的生成物的总能量 (填大于、小于或等于)反应物的总能量。
27.(7分)实验室因保存不慎会使烧碱溶液变质,这是因为(写离子方程式 )
为了检验一瓶烧碱溶液是否变质,应向试样中加入 ,若有 现象说明烧碱溶液已变质,为了除去变质的烧碱溶液中所含杂质 ,应加入适量的试剂是: ,反应的离子方程式: 。
|
|
|
|
|
|
|
|
|
|
(1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)配平步骤①的化学反应方程式,并标出电子转移的方向和数目。
□Na2Cr2O7+□KI+□HCl=□CrCl3+□NaCl+□KCl+□I2+□H2O
五、计算题(共8分)
29.(4分)加热19克碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为15.9g。计算原混合物中碳酸钠和碳酸氢钠的质量各是多少克?(保留一位小数)
30.(4分)在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。