高一化学期中考试题(二)
相对原子质量:H 1 C 12 O 16 Li 7 Na 23 K 39 Rb 85 Cs 133
第I卷 选择题(共54分)
一、选择题(每小题只有一个正确答案,每小题2分,计24分)
1.在化学反应中,如果某元素由化合态变为游离态,则该元素( )
A.被氧化 B.被还原
C.可能被氧化,也可能被还原 D.没有发生氧化还原反应
2.下列过程需要加入氧化剂才能实现的是( )
A.HCl →Cl2 B.HCO3― → CO2↑ C.Cu2+ →Cu D.MnO2 →Mn2+
3.下列叙述中正确的是 ( )
A.元素的单质可由氧化含该元素的化合物来制得
B.失电子越多的还原剂,其还原性就越强
C.阳离子只能得电子被还原,作氧化剂
D.含有最高价元素的化合物一定具有强氧化性
4.下列物质不属于强电解质的是( )
A.CaCO3 B.NaHCO3 C.Ba(OH)2 D.H2CO3
5.下列各种物质导电性最差的是
A.稀硫酸 B.固体食盐 C.铁丝 D.澄清的石灰水
6.对溶液中的离子反应,下列说法正确的是
①不可能是氧化还原反应 ②只能是复分解反应 ③可能是置换反应 ④不能没有分子参加
A.①③ B.③ C.①② D.③④
7.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即制冷。该化学物质是
A.氯化钠 B.生石灰 C.固体氢氧化钠 D.固体硝酸铵
8.已知反应X + Y = M + N为放热反应,对该反应的下列说法正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y 的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生反应
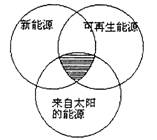 9.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( )
9.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( )
A.太阳能、风能、沼气
B.水能、生物能、天然气
C.煤炭、石油、潮汐能
D.地热能、海洋能、核能
10.将一小块金属钠投入FeCl3溶液中,观察到的现象是( )
A.钠溶解有铁析出并有气泡产生 B.只产生气体
C.只有沉淀 D.既有气体又有红褐色沉淀
11.对钠离子的叙述正确的是
A.具有强还原性 B.比钠原子稳定
C.半径比钠原子大 D.与水反应放出氢气
12.下列关于试剂保存的叙述正确的是( )
A.NaOH固体保存在配有橡胶塞的细口瓶中
B.Na2CO3溶液通常放在配有橡胶塞的广口瓶中
C.金属钠储存在煤油中
D.过氧化钠固体密封在干燥玻璃塞的广口瓶中
二、选择题(每小题只有一个正确答案,每小题3分,计30分)
13.在下列三个反应中:①H2O2+H2S ===2H2O+S↓;②2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
③H2O2+Cl2===2HCl+O2↑。从氧化还原角度分析,H2O2所起的作用依次是
A.①氧化剂 ②还原剂 ③氧化剂
B.①还原剂 ②氧化剂 ③氧化剂
C.①氧化剂 ②氧化剂 ③氧化剂
D.①氧化剂 ②既是氧化剂又是还原剂 ③还原剂
14.下列各组离子在溶液中可以大量共存的是
A.H+、NO3-、CO![]() 、SO
、SO![]() B.Cu2+、Cl-、NO
B.Cu2+、Cl-、NO![]() 、CO
、CO![]()
C.Mg2+、OH-、CO![]() 、H+ D.Mg2+、H+、SO
、H+ D.Mg2+、H+、SO![]() 、Cl-
、Cl-
15.下列离子方程式中错误的是( )
A.铁跟稀硫酸反应 Fe+2H+==Fe2++H2↑
B.碳酸氢钙溶液与稀盐酸反应2H++CO32― ==H2O+CO2↑
C.醋酸与氢氧化钾溶液 CH3COOH+OH-==CH3COO―+H2O
D.碳酸镁跟硫酸反应 MgCO3+2H+==Mg2++H2O+CO2↑
16.在一密闭容器中盛有过量的NaHCO3和少量的Na2O2,将其加热到300℃经充分反应后,排出气体,容器内残留的固体是:
A.NaHCO3和NaOH;B.Na2CO3和NaOH;C.NaHCO3和Na2CO3;D.只有Na2CO3
17.能用来鉴别浓度相同的NaHCO3、Na2CO3溶液的试剂是( )
A.CO2 B.Ca(OH)2 C.盐酸 D.NaOH
18.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,根据碱金属性质预测其性质,其中不正确的是( )
A.在碱金属元素中它具有最大的原子半径
B.钫在空气中燃烧时,只生成分子式为Fr20的氧化物
C.它的氢氧化物分子式为FrOH,这是一种极强的碱
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
19.R、X、Y和Z是四元素,其常见化合价均为+2价,且X2+与单质R不反应: X2+ + Z === X + Z2+ ;Y + Z2+ === Y2+ + Z。这中种离子被还原成0价时表现的氧化性大小符合
A.R2+>X2+>Z2+>Y2+ B. X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D. Z2+>X2+ >R2+>Y2+
20.已知(l)![]() =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·![]()
(2)![]() =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·![]()
(3)![]() =H2O(l) △H3=c
kJ·
=H2O(l) △H3=c
kJ·![]()
(4)![]() =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·![]()
下列关系式中正确的是
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
21.当金属铷(85)和另一碱金属等物质的量组成的合金4.6克跟水完全反应时,产生氢气在标准状况下为2.24L,则合金中的另一种金属可能是( )
A.Na; B.Li; C.K; D.Cs
22.2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体质量增加( )
A.2.1g B.3.6g C.7.2g D.无法判断
第II卷 非选择题(共46分)
三、填空题(共小题,计24分)
23.(6分)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO![]() 、SO
、SO![]() (每种离子只能用一次),现将溶液两两混合,记录现象如下:
(每种离子只能用一次),现将溶液两两混合,记录现象如下:
A+B![]() 白色沉淀 A+C
白色沉淀 A+C![]() 白色沉淀 B+D
白色沉淀 B+D![]() 白色沉淀
白色沉淀
A+D![]() 白色沉淀 C+D
白色沉淀 C+D![]() 蓝色沉淀
蓝色沉淀
(1)已知Ag2SO4是微溶性白色沉淀,则A、B、C、D的化学式分别是 、 、 、 。
(2)写出C与D反应的离子方程式 。
24.(4分)利用下列反应原理可以用于检验司机是否酒后驾车。
2K2Cr2O7 + 3C2H5OH + 8H2SO4 === 2Cr2(SO4)3 + 3CH3COOH + 2K2SO4 + 11H2O
橙色 绿色
C2H5OH为乙醇 CH3COOH为乙酸
(1)若司机酒后驾车,显示出 色;
(2)在反应中铬(Cr)元素的化合价从 价变为 价;
(3)反应中电子转移数为 。
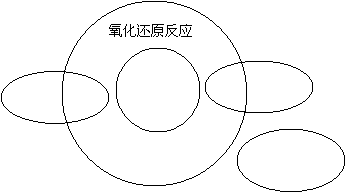
25.(4分)下图表示分解、化合、置换、复分解四种反应类型和氧化还原反应的关系,请它们的对应关系填入下图中:

26.(8分) 某银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B。将A、B投入水中都生成D;B与C分别与二氧化碳反应,都有生成D。则A是______;B是_______;C是______;D是________。B与CO2反应的化学方程式为____________________,D与二氧化碳反应的离子方程式为______________________________。
27.(2分)做焰色反应时,铂丝应用 清洗后在火焰上灼烧至无色,观察K的焰色的方法是 。
四、实验题(计10分)
28.今用下列仪器做过氧化钠纯度实验,下图中A、B、C、D、E、F表示玻璃管的接口
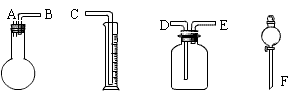

① ② ③ ④
(1)各仪器接口字母的连接顺序为: ;
(2)仪器①中放药品为 ,④中放药品为 ,③中应充满 ,②的作用是 ;
(3)写出①中反应的化学方程式 ;
(4)如果称量出Ag 该过氧化钠样品,测得氧气的质量为Bg,则过氧化钠样品中Na2O2的质量分数为 。
五、计算题(共2小题,计12分)
29.(6分)将表面已被部分氧化为Na2O的10.8g金属钠放入80g水中,充分反应后收集到0.2g氢气。试求:
(1)原钠块中钠和氧化钠的质量。
(2)所得NaOH溶液中溶质的质量分数。
30.(6分)取等质量混合的Na2CO3和NaHCO3混合物20g,加热一段时间后,称得固体质量变为16.9g,求混合物中NaHCO3的分解率。
参考答案
一、1——12 C A A D B B D C A D B C
二、13——22 C D B D C B A C B A
三、23.AgNO3 MgCl2 CuSO4 NaOH
24.(1)绿色;(2)+6;+3;(3)6e
![]()
![]()
|
|


26.钠;过氧化钠;氢氧化钠;碳酸钠;2Na2O2+2CO2===2Na2CO3+O2;CO2+2OH-===CO32-+H2O
27.稀盐酸;透过蓝色钴玻璃观察。
四、28.(1)F——A——B——E——D——C;(2)过氧化钠样品;水;水;测量生成O2的体积;(3)2Na2O2+2H2O===4NaOH+O2;(4)![]()
五、29.(1)Na 4.6g;Na2O 6.2g;(2)17.66%
30.84%