高一化学期中试卷
参考的相对原子质量:Na: 23 H :1. O:16 Cl:35.5 S:32 K:39 I:127
第I卷(选项择题;共56分)
一、选择题(1~8每题只有一个正确答案,3,*8=24,将答案填在答题卡中,下同)
1.设NA代表阿伏加德罗常数.下列说法正确的
A.18g水所含的电子数目为NA
B.32g氧气所含的原子数目为NA
C.在常温常压下11.2L氯气所含的原子数目为NA
D.2.3g金属钠变为钠离子时失去的电子数目为0.1NA
2.质子数为12的元素A跟质子数为7的元素B组成化合物是
A.A2B5 B.A3B2 C.A2B3 D.A5B2
3.下列物质中,能与TiCl4 反应生产金属钛的是
A.Na2O2 B.NaOH C.H2O2 D.Na
4、日常生活中,常会接触到下列物质:空气、乙醇、碘酒、氢气、石墨、食盐水、铜、硫酸铵。其中属于混和物的是
A、5种 B、4种 C、3种 D、2种
5、以下物质通常情况下属于晶体的是
A、煤 B、玻璃 C、硫酸铵 D、橡皮
6、溶液属于分散系,下列选项中属于溶液中分散质微粒直径的是
A、大于10-7m B、在10-9~10-7m之间 C、小于10-9m D、小于10-7m
7根据反应:CuCl2+Fe=FeCl2+Cu、2FeCl3+Cu=2FeCl2+CuCl2、FeCl2+Zn=ZnCl2+Fe,判断下列物质的还原性强弱,正确的是:
A.Zn>Fe>Cu B.FeCl3>FeCl2>CuCl2
C.CuCl2>FeCl3>FeCl2 D.Cu>Fe>Zn
8.下列试剂保存不正确的是
A.碘必须保存在煤油中 B.新制的氯水用棕色试剂瓶装并密封保存
C.金属钠保存煤油在中 D.液溴用一薄层水封盖再密闭保存于低温处
二、选择题(每小题有1~2个正确答案,选错为零分,如有两个正确答案选一个且正确的得2分,4,*8=32,)
9.关于卤素(F、Cl、Br、I)的化学性质的叙述,错误的是
A.随原子半径逐渐增大,单质跟水的反应能力逐渐减弱
B、随原子半径逐渐增大,单质的氧化性逐渐减弱
C.随离子半径逐渐增大,离子的氧化性逐渐增强
D.溴化氢与氯气混合后,会有棕红色气体出现
10.Cl、Cl-、Cl2的主要区别是
A.结构不同,存在相同,性质不同 B.结构不同,存在不同,性质不同
C.结构不同,存在不同,性质相同 D.结构相同,存在不同,性质不同
11.检验烧碱中含有纯碱的方法是。
A.加热有气体生成 B.加入BaCl2溶液产生白色沉淀
C.加入盐酸有气体生成,该气体可使澄清石灰水变浑浊 D.焰色反应为黄色
12.钾的金属活动性比钠强的实质是。
A.钾的密度比钠的小; B.钾原子的电子层比钠原子多一层;
C.钾比钠与水反应更剧烈; D.加热时钾比钠更易汽化。
13.下列反应的离子方程式不正确的是
A.金属钾和水反应2K++2H2O=2K++2OH-+H2 ↑
B.石灰石溶于盐酸CaCO3+2H+=Ca2++H2O+CO2↑
C.澄清的石灰水和盐酸反应H++OH-=H2O
D.小苏打溶于盐酸CO32-+2H+=CO2↑+H2O
14、氯化碘(ICl)的化学性质与氯气的化学性质相似,预计它与水反应的最初生成物是
A、HI和HClO B、HCl和HIO C、HClO3和HIO D、HClO和HIO
15、下列物质中属于电解质的是
A、CO2、SO2、HCl B、 H2SO4 、HNO3、 BaCl2
C、 H3PO4、 H2 、Cu D NH3 、CH4、 NaF
16、氯仿在空气中能发生缓慢氧化,化学方程式为:2CHCl3+O2=2COCl2+2HCl (CHCl3和COCl2都是非电解质)。检验氯仿是否发生氧化应选用的试剂是
A、水和PH试纸 B、NaOH溶液 C、酚酞溶液 D、硝酸酸化的硝酸银溶液
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 答案 | |||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |
| 答案 |
第II卷 (非选择题;共64分)
三.填空(31分)
17、(2分)干燥的氯气不能使红纸条褪色,这是因为 ,干燥的蓝色石蕊试纸遇氯化氢气体也不变红色,这是因为
18、(2分)鉴别NaCl溶液、NaBr溶液及NaI溶液,可向其溶液中滴加 溶液, 发现有 现象的一份原溶液为NaCl溶液。
19、(4分)A、B、C、D 四种化合物,其焰色反应均为紫色。A、B、C 分别与盐酸反应均可得到 D ;B、C 在溶液中反应可得到 A 。若向 B 溶液中通入 CO2 气体时可得到 A ,通入 CO2 过量时得到 C 。则 A、B、C、D 的化学式分别为:A 、B 、C 、D 。
20 、(3分)S2-微粒中质子数是 ,中子数是 ,核外电子数是
21、(5分)请写出5种化学性质不同的物质的分子式,这些分子都具有10个电子。它们分别是:
22、(6分)实验室可以用高锰酸钾和浓盐酸反应制氯气,反应的化学方程式如下: 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑ +8H2O
(1)试用单线桥式分析,指出电子转移方向和总数
(2)该反应中,氧化剂是 ,还原剂是
(3)当有0.4mol电子发生转移时,生成氯气的体积是 (标准状况)
23、(9分)某化学课外小组以海带为原料获得少量碘水,并以CCl4为溶剂把碘从碘水中提取出来,过程如下:
→含碘的CCl4溶液→含碘化钾的水溶液![]() 含碘单质的水溶液
含碘单质的水溶液![]() →水溶液海带
→水溶液海带 ![]() 海带灰
海带灰![]()
![]() →固体残留物
→固体残留物
a、试剂A、B、C的名称依次是 b、操作(1)、(2)、(3)、名称依次是
c、操作(2)反应方程式是 d、操作(3)中的C能否用酒精代替? 为什么?
四、简答题(18分)
24、(4分)写出氯气和氢氧化钙溶液反应的离子方程式,并指出漂白粉的主要成分和有效成分
25、(14分)(如图)用二氧化锰和浓盐酸制氯气:
问题:①A装置中反应的化学方程式
②B装置中所盛试剂为 ,作用为
③C装置中所盛试剂为 ,作用为
④E装置中所盛试剂为 ,作用为
反应的化学方程式为
⑤D装置中的实验现象为
⑥B和C两装置可否颠倒 为什么
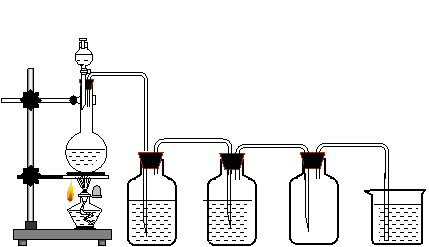
A B C D E
五、计算题(15分)
26、(6分)483gNa2SO4·10H2O中所含的Na+和SO42-的物质的量各是多少?所含水分子的数目是多少?
27、(9分)下表是某地市场上的一种“加碘食盐”包装袋上的部分文字说明。
| 配料 | 氧化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg·Kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
(1) 加碘盐不能长时间炖炒、且应避热、避光保存、你认为可能的原因是什么?
(2) 实验分析发现某批加碘盐中KIO3的含量为52mg·Kg-1,试计算每千克加碘盐中KIO3的物质的量和碘的质量
(3) 若成人每天需摄入0.15~0.20mg碘才能满足人体健康的需要,通过计算说明成人平均每天至少食用多少克这种加碘盐才能获取所需的碘?
参考答案:
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 答案 | D | B | D | C | C | C | A | A | |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |
| 答案 | C | B | BC | B | AD | B | B | AD |
17、无HClO、无H+
18、AgNO3溶液,白色沉淀(其它合理答案也得分)
19、A、K2CO3、B、KOH、C、KHCO3、D、KCl
20、16、16、18
21、NH3、CH4、H2O、HF、Ne
22、(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑ +8H2O
(2)KMnO4、HCl、(3)4.48升
23、a、水、氯水、四氯化碳 b、过滤、振荡、萃取-分液 c、2KI+Cl2=2KCl+I2 d、否、互溶或不分层
24、2OH-+Cl2=ClO-+Cl-+H2O、Ca(ClO)2和CaCl2、Ca(ClO)2
25、① MnO2+4HCl(浓)![]() 2MnCl+Cl2↑+2H2O
2MnCl+Cl2↑+2H2O
②饱和食盐水、除去HCl气体
③浓硫酸、干燥剂
④NaOH 溶液、吸收多余Cl2, 防止污染空气、2NaOH+Cl2==NaCl+NaClO+H2O
⑤无色气体变成黃绿色
⑥否、若颠倒就不能除去氯化氢气体
26、解:n(Na2SO4·10H2O)=483g/322g·mol-1 =1.5mol
n(Na+)=2*1.5mol=3.0mol,n(SO42-)=1.5mol, N(H2O)=10*1.5mol*6.02*1023mol-1=9.03*1024
27、解:(1)防止碘损失,(2)n(KIO3)=52mg·Kg-1*1Kg*10-3g·mg-1/214g·mol-1 =2.43*10-4mol m(I)=2.43*10-4mol*127g·mol-1=308.61*10-4g=30.86mg
(3)0.15mg÷30.86mg×1000g=4.86g