高一化学第一学期第一次检测
化 学 试 卷
说明:1、密封线内不要答题。
2、答案一律写在答案卷上。
3、教改班共28题,其他班级27题。
4、可能用到的相对原子质量:
Na-23 Cl-35.5 S-32 H-1 O-16 C-12 Ag-108 Fe-56 Cu-64
第Ⅰ卷 (选择题 共55分)
一、选择题(本题共5小题,每小题只有一个选项符合题意,每题2分)
1.下列反应中一定不属于氧化还原反应的是 ( )
A.复分解反应 B.分解反应
C.置换反应 D.化合反应
2.有下列物质:①Br2 ②CH3CH2OH(乙醇) ③CH3COOH ④Na2S ⑤C12H22O11(蔗糖)
⑥HNO3 ⑦CaCO3 ⑧NH3 ⑨饱和食盐水。其中属于电解质的是 ( )
A.③④⑥⑦⑧ B.②③④⑥⑦⑧
C.③④⑥⑦⑨ D.③④⑥⑦
3.下列物质混合后不能发生离子反应的是 ( )
A.CuSO4溶液和NaOH溶液 B.Fe粉投入盐酸溶液中
C.H2SO4溶液和NaCl溶液 D.Na2CO3溶液和HCl溶液
4.下列说法正确的是 ( )
A.在氧化还原反应中,非金属单质一定是氧化剂
B.某元素从化合态变为游离态时,一定被还原
C.在同一氧化还原反应中,失电子数目一定等于得电子数目
D.在氧化还原反应中,一种元素得到电子则必有另一种元素失去电子
5.下列电解质的电离方程式正确的是 ( )
A.Na2SO4 = Na++SO42-
B.H2CO3![]() 2H++CO32-
2H++CO32-
C.NaHSO4 = Na++HSO4-
D.NH3·H2O![]() NH4++OH-
NH4++OH-
二、选择题(本题共15小题,每小题有一或二个选项符合题意,每题3分)
6.下列物质中属于强电解质的是 ( )
A.CH3COOH B.硫酸钡
C.氨气 D.硝酸钾溶液
7.下列离子反应方程式正确的是 ( )
A.醋酸和氢氧化钠溶液反应:H++OH-=H2O
B.CaCO3悬浊液中通入二氧化碳气体变为澄清溶液:CaCO3+CO2+H2O=Ca2++2HCO3-
C.实验室制取H2:Zn+2H++SO42-=ZnSO4+H2↑
D.硫酸和氢氧化钡溶液的反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
8.下列离子组中的离子,在无色强酸性的环境中能大量共存的是 ( )
A.NH4+、Al3+、SO42-、NO3- B.K+、Na+、CO32-、NO3-
C.K+、Na+、MnO4-、SO42- D.Ca2+、NH4+、Cl-、SO42-
9.根据下列反应的化学方程式,判断有关物质的还原性顺序正确的是 ( )
① I2+SO2+H2O=H2SO4+2HI ② 2FeCl2+Cl2=2FeCl3
③ 2FeCl3+2HI=2FeCl2+I2+2HCl
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
10.下列微粒只有还原性的是 ( )
A.Cl- B.Cl
C.H+ D.H2O
11.3个SO32-离子恰好将2个XO4-离子还原,而SO32-离子被氧化为SO42-,则X元素在还原产物中的化合价是 ( )
A.+1 B.+2
C.+3 D.+4
12.下列各组中两种溶液间的反应,均可用同一离子方程式表示的是 ( )
(提示:NH4++OH-=NH3·H2O)
A.CH3COOH+Na2CO3;CH3COOH+NaHCO3
B.AgNO3+HCl; AgNO3+MgCl2
C.BaCl2+Na2SO4; Ba(OH)2+(NH4)2SO4
D.Ba(OH)2 + H2SO4; HCl + NaOH
13.下列变化需要加还原剂才能实现的是 ( )
![]()
![]() A.MnO4- Mn2+
B.Cu2+ Cu
A.MnO4- Mn2+
B.Cu2+ Cu
![]()
![]() C.Cl-
Cl2
D.H2S SO2
C.Cl-
Cl2
D.H2S SO2
14.下列说法正确的是 ( )
A.离子反应中,参加反应的阴、阳离子个数必定相等
B.离子方程式中,离子所带电荷的代数和一定要等于零
C.离子方程式中,反应物离子电荷的总数一定等于生成物离子的电荷总数
D.若没有气体、沉淀和难电离物质生成,离子反应就不能进行
15.强电解质与弱电解质的不同点在于 ( )
A.强电解质溶液的导电能力一定强,而弱电解质溶液的导电能力一定弱
B.强电解质形成的是饱和溶液,而弱电解质形成的是不饱和溶液
C.强电解质是可溶性化合物,而弱电解质是难溶性化合物
D.强电解质水溶液不存在电解质分子,而弱电解质水溶液中存在溶质分子
16.用稀硫酸酸化的H2O2溶液中,加入乙醚(CH3CH2-O-CH2CH3)后液体分层,再加入少量的K2Cr2O7溶液并振荡,在乙醚层中出现深蓝色,这是因为生成深蓝色的2CrO5·(C2H5)2O所致。其主要反应的离子方程式为:Cr2O72- + 4H2O2 + 2H+ = 2CrO5 + 5H2O,下列叙述中不正确的是 ( )
A.Cr2O72-离子被氧化成CrO5 B.该反应属于氧化还原反应
C.反应中H2O2被氧化成H2O D.若有4个H2O2分子反应,则转移了8个电子
17.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的微粒个数之比为2∶1时,还原产物是 ( )
A.NO2 B.NO
C.N2O D.N2
18.单质X和Y相互反应生成![]() ,现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④Y2-是还原产物;⑤Y2-具有还原性;⑥X2+具氧化性;⑦Y的氧化性比X2+的氧化性强,其中正确的
(
)
,现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④Y2-是还原产物;⑤Y2-具有还原性;⑥X2+具氧化性;⑦Y的氧化性比X2+的氧化性强,其中正确的
(
)
A.1、2、3、4 B.1、4、5、6、7
C.2、3、4 D.1、3、4、5
19.下列叙述正确的是 ( )
A.NaOH溶液能导电,所以NaOH溶液是电解质
B.固体KCl不能导电,但KCl是电解质
C.氯化氢的水溶液能导电,所以HCl是电解质
D.CO2 的水溶液能导电,所以CO2是电解质
20.加入氢氧化钠溶液后,溶液中哪些离子数目明显减少 ( )
A. 碳酸根离子 B.镁离子
C.硫酸根离子 D.碳酸氢根离子
第Ⅱ卷 (非选择题 共45分)
三、填空题(本题共9小题)
21.(教改班不做,6分)写出下列要求的方程式:
(1)、Fe(NO3)3的电离方程式:________________________________________________。
(2)、HCl和Cu(OH)2反应的离子方程式:______________________________________。
(3)、符合2H++CO32-=H2O+CO2↑的化学方程式:____________________________。
22.(4分)向CH3COOH溶液中滴加NaOH溶液时,溶液的导电性____________(填“逐渐增强”、“逐渐减弱”或“基本不变”,下同),向NaOH溶液中滴加CH3COOH时,溶液的导电性__________。
23.(教改班不做,8分)用双线桥表示下列氧化还原反应的变化过程。
2 FeCl3 + Cu = 2 FeCl2 + CuCl2 被还原元素_______,还原剂____ __。
3 S + 6 NaOH = 2 Na2S + Na2SO3 + 3 H2O 被氧化元素_______,还原剂_______。
24.(仅教改班做,4分)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:______________________;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_______________________ 。
25.(仅教改班做,4分)完成下面两小题:
(1)Al(OH)3的电离方程式:______________________________________________ 。
(2)KClO3与浓盐酸混合加热生成氯气:____________________________________ 。
26.(4分)一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3——HNO3 + N2 + H2O,在反应中被氧化与被还原的氮原子数之比为_______ 。
27.(7分)A、B、C、D四支试管中分别盛有 H2SO4、Na2CO3、BaCl2、NaOH四种无色溶液。将A试管中的溶液分别倒入其他三支试管,B试管中无明显现象,C试管中则产生了白色沉淀,D试管中有气泡产生。据此现象,判断四支试管中分别盛有哪种试剂,写出有关离子方程式。
A:________ B:________ C:________ D:_________(填化学式)
离子方程式(若无反应则可不写):
A+B:______________________________________
A+C:______________________________________
A+D:______________________________________
28.(仅教改班做,5分)已知Br2的氧化性比Fe3+强,I-的还原性比Br-强。向含有Cl-、Br-、I-、Fe2+的溶液中加入溴水,反应后溶液中离子数目明显减少的是_______ ,离子数目明显增多的是_____ ,离子数目基本不变的是______ 。有关离子方程式是__________________。
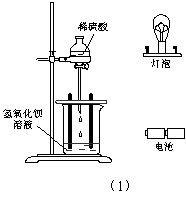
29.(8分)下图是研究H2SO4溶液滴入Ba(OH)2溶液时,溶液导电性变化的实验装置图。
(1)用导线将实验装置的电路接好。
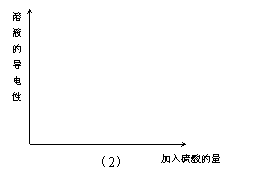
(2)画出随H2SO4溶液的不断滴入,溶液导电性变化的曲线。
(3)实验过程中的现象是___________________________________。
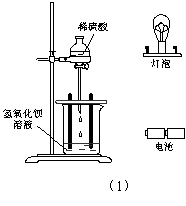 (4)反应的离子方程式是___________________________________。
(4)反应的离子方程式是___________________________________。
 |
四、计算题(本题共2小题,教改班做31题,其他班级做30题)
30.(8分) KMnO4是常用的氧化剂,它在与浓盐酸反应时,MnO4-被还原为Mn2+,发生如下反应:2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O 写出在室温下,用高锰酸钾跟浓盐酸反应制氯气的离子反应方程式。若反应中生成了17.75 g氯气,问有多少克HCl被氧化?有多少克36.5 %的盐酸参加了反应?(已知氯气的相对分子质量为71)
31.(仅教改班做,9分)AgCl和Ag2CO3的固体混合物4.195g,用足量盐酸处理后,到不再产生CO2为止,沉淀物的质量为4.305g。(1)写出反应的离子方程式;(2)求源混合物中AgCl和Ag2CO3的质量各为多少克?
高一化学单元检测
第Ⅰ卷 (选择题 共55分)
一、选择题(每题2分)
| 1 | 2 | 3 | 4 | 5 |
二、选择题(每题3分)
| 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 |
第Ⅱ卷 (非选择题 共45分)
三、填空题
21.(教改班不做,6分)
(1)________________________________
(2)________________________________
(3)________________________________
22.(4分)
导电性_________ ;导电性_________
23.(教改班不做,8分)
2 FeCl3 + Cu = 2 FeCl2 + CuCl2 被还原元素_______,还原剂________。
3 S + 6 NaOH = 2 Na2S + Na2SO3 + 3 H2O 被氧化元素_______,还原剂_______。
24.(仅教改班做,4分)
反应的离子方程式:___________________________
反应的离子方程式:___________________________
25.(仅教改班做,4分)
(1)_________________________________
(2)_________________________________
26.(4分)
被氧化与被还原的氮原子数之比为 _____
27.(7分)
A:________ B:________ C:________ D:_________(填化学式)
离子方程式(若无反应则可不写):
A+B:_______________________________
A+C:_______________________________
A+D:_______________________________
28.(仅教改班做,5分)
离子数目明显减少的是____ 离子数目明显增多的是____ 离子数目基本不变的
是__有关离子方程式是____________________________
29.(8分)
(1)用导线将实验装置的电路接好。
 (2)画出随H2SO4溶液的不断滴入,溶液导电性变化的曲线图。
(2)画出随H2SO4溶液的不断滴入,溶液导电性变化的曲线图。
 |
(3)实验过程中的现象是
_____________________________。
(4)反应的离子方程式是
_____________________________。
四、计算题
30.(8分)
31.(仅教改班做,9分)