高一化学第一学期期末考
化 学 试 卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分,考试时间120分钟。
可能用到的相对原子质量H-1 C-12 S-32 N-14 O-16 F-19
Na-23 Mg 24 Cl-35.5 Fe-56 Cu-64 Br-80 Ag-108 Zn-65
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括9小题,每小题4分,共36分,每小题只有一个选项符合题意)
1.下列燃料中,不属于化石燃料的是
A.煤矿
B.石油 C.天然气 D.水煤气
2.实验室收集Cl2,最好选用
A.排饱和食盐水法 B.向下排空气法 C.排水法 D.向上排空气法
3.在a.b.c.d四个集气瓶中分别盛有H2、Cl2、HCl、HBr中的任一种气体。若将a和d两瓶气体混合后见强光爆炸;若将a和b两瓶气体混合后,瓶壁上出现红棕色小液滴。则a.b.c.d四个集气瓶中分别盛放的气体是
A.Cl2、H2、HCl、HBr B.Cl2、HCl、HBr、H2
C.Cl2、HBr、H2、HCl D.Cl2、HBr、HCl、H2
4.下列标记,不需要在容量瓶上标有的是
A.标线 B.温度 C.浓度 D.容量
5.宣传科学知识,揭露伪科学是科学工作者和青少年学生的权利和义务。下列各项叙述在科学性上没有错误的是
A.用特殊的催化剂可将水变成石油
B.溴化银可用于人工降雨
C.这种饮料不含任何化学物质,绝对纯净
D.煤的气化和液化是高效、清洁地利用煤炭的重要途径
6.20℃时,向一瓶Na2CO3饱和溶液中加入少量Na2CO3·10H2O晶体,则
A.晶体质量减少 B.溶质的质量分数增大
C.晶体质量不变 D.无法确定
7.下列叙述中正确的是
A.摩尔是国际单位制中七个基本物理量之一 B.硫酸的摩尔质量是98g
C.1 mol任何物质都含有约6.02×1023个原子 D.1 molN2的质量是28g
8.在含有溴化钾和碘化钾的混合溶液里通入过量氯气,然后把此溶液蒸干、灼烧;得到的固体物质是
A.KCl B.KCl和KBr C.I2 D.Br2
9.某密闭容器的质量为50.0g,当它装满CO2气体质量为58.8g,如果在同样条件下改为装满CH4气体,其质量应为
A.3.2g B.58.8g C.22.4g D.53.2g
二、选择题(本题包括9小题,每小题4分,共36分,每小题有一个或两个选项符合题意。若该小题只有一个正确答案,多选为0分,若该小题有两个选项符合题意,只选一个且正确的得2分,但只要选错一个就为0分)
10.下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积可能是22.4L
11.下列各物质属于非电解质的是
①NaOH ②蔗糖 ③铜 ④Na2CO3 ⑤酒精 ⑥CaO
⑦CO2 ⑧醋酸 ⑨氯水 ⑩CaCO3
A.②③⑦⑩ B.②③⑤⑦ C.②⑤⑦ D.②⑦⑧⑨
12.根据下列反应:(1)2Fe3++2I-=2Fe2++I2 ; (2)Br2+2Fe2+=2Br-+2Fe3+ 判断离子的还原性由强到弱的顺序是
A.Br->Fe2+>I- B. Fe2+>I->Br-
C.Br->I->Fe2+ D.I->Fe2+>Br-
13.在酸性的无色透明溶液中,能大量共存的离子组是
A.Ba2+、Ag+、NO3-、Cl- B. K+、Cu2+、NO3-、MnO4-
C.HCO3-、K+、SO42-、Cl- D.Mg2+、NH4+、NO3-、Cl-
14.下列离子方程式中,书写不正确的是
A.氯化钠溶液中加入硝酸银溶液:Ag+ + Cl-=AgCl↓
B.把金属钠放入水中:Na + 2H2O = Na+ +2OH-+ H2↑
C.将溴水加入碘化钾溶液中:Br2 + 2I-=2Br- + I2
D.盐酸滴在石灰石上:CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
15.在一个量气管中充入1/4体积的N2、1/2体积的Cl2、1/4体积的H2,让日光照射一段时间后,倒立在水中,再让日光照射一段时间,则进入量气管中的水占量气管体积的
A.1/3 B.1/2 C. 5/8 D.3/8
16.甲、乙两烧杯中分别加入等体积、等浓度的稀H2SO4,向甲烧杯中加入m gMg,向乙烧杯中加入m gZn。待反应完毕后,一烧杯中仍有金属未溶解,则甲、乙烧杯中原来的H2SO4物质的量x值的取值范围是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
17.绝大多数盐类是强电解质,而醋酸铅是弱电解质。能证明醋酸是弱电解质的方法是
①比较相同浓度的醋酸铅和硫酸镁溶液的导电性 ②硫酸铅沉淀中加入醋酸铵,沉淀消失 ③测定醋酸铅的熔点 ④测定醋酸铅的溶解度
A.①② B.①③ C.②④ D.③④
18.在体积为VmL密度为ρg/cm3的溶液中,含有式量为M的溶质mg,其物质的量浓度为c mol/L,溶质质量分数为ω%,下列表示式中正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
第Ⅱ卷(非选择题,共78分)
三、实验题(本题包括2小题,共25分)
19.(11分) (1)下列说法正确的是 (3分,答对1个1分,错一个扣1分)
A 氯水应该保存在无色的细口玻璃瓶中
B 少量金属钠应该保存在煤油中
C 分离碘和沙子的混合物可选用升华法
D 液溴应该保存在棕色试剂瓶中,并加少量水,减少其挥发
E 在碘水中加入适量的CCl4,振荡静置后,上层溶液应该为紫红色
(2)(每空2分,共6分)配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,请回答以下问题:
①应称量NaOH的质量 g,
②应选用容量瓶的规格 mL,
③将已称量好的氢氧化钠固体配成溶液,除容量瓶外还需要的其它仪器 。
(3)下列操作对所配制的NaOH溶液浓度有偏高影响的是 (2分,答对1个给1分,错选一个扣1分)。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.定容时俯视容量瓶中的液体
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.将称量的NaOH固体露置在空气中的时间过长
20.(每空2分,共14分)分析下列实验图,回答有关问题
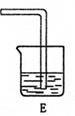
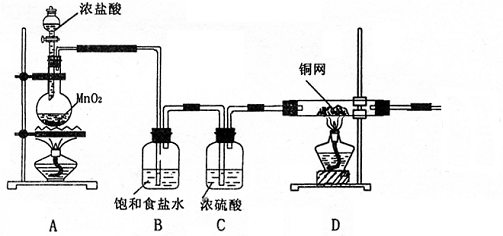
(1)写出A中发生反应的离子方程式 。
(2)上图中B、C两个装置能否调换位置 (填“能”与“不能”),原因是
(3)实验开始时,对于A、D两处的酒精灯,应该先点燃 。
(4)在D中观察到的现象是 。
(5)尾气吸收的溶液为 ,其中发生反应的离子方程式为 。
四、填空题(本题包括5小题,共34分)
21. (2分) 质量分数相等的Na2CO3和NaHCO3的混合物x g ,加热一段时间后,质量变为y g,当y为何值时,表明NaHCO3已完全分解 (用含x、y的式子表示)
22. (6分)标准状况下8.96L的CH4和CO的混合气体的质量为7.6g,则:
(1)此混合气体的平均摩尔质量为 ;
(2)上述混合气体中CH4的体积为 ;
(3)若将上述混合气体与标准状况下的16.8 L O2混合点燃,完全反应后恢复到原来的温度和压强,则所得气体的相对分子质量为 。
23.(14分)如下图所示,A为银白色金属,C为淡黄色固体,A、B、C、D、E、F中均含有同一种元素。常温下G为液态,H为气态。
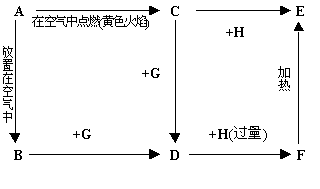 |
试回答:(1) 写出化学式:C ,D ,F ,
G ,H 。
(2) A与水反应的离子方程式为: 。
(3) 写出F→E的化学方程式: 。
24.(6分)在1968年,化学家用刚发现不久的XeF2(二氟化氙)和KBrO3首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟仍以化合态留在水溶液中,则每生成1molO2,转移电子数为 mol;该反应的氧化剂是 。
(2)写出XeF2与含KOH、KBrO3的水溶液反应得到KBrO4的化学方程式:
。
25.(6分)在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下述实验:(1)用pH试纸检验,该溶液呈强酸性;(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;(3)另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。根据上述实验现象,推断原溶液中肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 。
五、计算题(本题包括2小题,共19分)
26.(8分)某盐酸的密度为1.05g/cm3,其中HCl的质量分数为10% 。试回答:
(1)该盐酸的物质的量浓度为多少?
(2)200mL该盐酸跟过量的铁粉充分反应,生成H2的体积(标准状况)是多少升?生成的FeCl2的物质的量是多少?
27.(11分)(1)Na2O和Na2O2的混合物140g和足量水作用,得到4L溶液,其中含溶质160g。试计算原混合物中Na2O2的质量。
(2)若Na2O和Na2O2的混合物质量为Wg ,和足量水作用后得到的溶液中,所含溶质的质量较原混合物增加了Xg 。试写出X的数值大小范围(以含W的代数式表示之)。
参考答案
一、二选择题(每题4分,共72分)
1、D 2、A 3、D 4、C 5、A 6、C 7、D 8、B 9、D 10、BD 11、C 12、D 13、D 14、B 15、C 16、C 17、A 18、BD
三、实验题(本题包括2小题,19(1)是3分,其余每空2分,共25分)
19.(11分)(1) BCD(2)①4g,②500mL,③量筒、烧杯、玻璃棒、胶头滴管(3) BD
20.(14分)(1)MnO2 +
4H+ + 2Cl-![]() Mn2+ + Cl2↑+ 2H2O(2)不能。若调换过来,通过饱和食盐水时带出的水蒸气将无法除去。(3)A ;(4)产生棕黄色的烟;(5)NaOH溶液(或KOH溶液,但不能用NH3·H2O或Ca(OH)2溶液),Cl2 + 2OH- === Cl- + ClO- + H2O
Mn2+ + Cl2↑+ 2H2O(2)不能。若调换过来,通过饱和食盐水时带出的水蒸气将无法除去。(3)A ;(4)产生棕黄色的烟;(5)NaOH溶液(或KOH溶液,但不能用NH3·H2O或Ca(OH)2溶液),Cl2 + 2OH- === Cl- + ClO- + H2O
四、填空题(本题包括5小题,每空2分,共34分)
21.(2分) y=137x/168 (用含x,y的式子表示)
22.(6分) (1) 19g/mol ;(2) 6.72L ;(3) 41.6 。
23.(14分) (1) Na2O2 , NaOH , NaHCO3 , H2O ,CO2
(2) 2Na + 2H2O === 2Na+ + 2OH- + H2↑
![]() (3) 2NaHCO3
====== Na2CO3
+ CO2↑+ H2O
(3) 2NaHCO3
====== Na2CO3
+ CO2↑+ H2O
24.(6分)(1)4mol , XeF2 (2)XeF2 +2KOH + KBrO3 === Xe↑ + 2KF + KBrO4 +H2O
25.(6分) H+、I-、Ba2+, CO32-、SO42-, K+。
五、计算题(本题包括2小题,共19分)
26(8分).解:(1) C(HCl)=(1.05g/mL×1000 mL /L×10% )÷36.5 g/mol=2.88mol/L(3分)
(2)设生成H2的体积(标准状况)是V(H2) ,生成FeCl2的物质的量是n(FeCl2)
由于参加反应的HCl的物质的量为2.88mol/L×0.2 L=0.58 mol(1分)
![]() Fe + 2HCl = FeCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
|
0.58 mol n(FeCl2) V(H2)
![]() 所以 n(FeCl2)=0.29 mol
V(H2)=6.5 L
所以 n(FeCl2)=0.29 mol
V(H2)=6.5 L
|
(2)生成H2的体积(标准状况)是6.5 L;生成的FeCl2的物质的量是0.29 mol
27.(11分)解: (1)(5分)依题意:Na2O + H2O === 2NaOH 2Na2O2 + 2H2O === 4NaOH+O2 ↑
故所得溶液中溶质为NaOH,nNaOH =160g/40g·mol-1 = 4 mol(1分)
![]() 设混合物中Na2O 、Na2O2的物质的量分别为x mol,y mol .
设混合物中Na2O 、Na2O2的物质的量分别为x mol,y mol .
|
则:
2x + 2y = 4
解之得:x=1 mol , y=1mol
|
![]() (2)若该混合物全为Na2O ,
(2)若该混合物全为Na2O ,
则: Na2O + H2O === 2NaOH △m
|
Wg Xg
X= 18W/62 = 9W/31
![]() 若该混合物全为Na2O2 ,
若该混合物全为Na2O2 ,
|
156 160 160-156 = 4
Wg Xg
X= 4W/156 = W/31
所以,X的数值大小范围为:W/39<X<9W/31 2分
答:X的数值大小范围为:W/39<X<9W/31
化学试题答卷
班别 座号 姓名 分数
一、二.选择题(每小题4分,共76分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 答案 | 。 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
| 答案 |
三.实验题(19(1)3分,其余每空2分,共25分)
19.(11分)(1) ;(2)① 、② 、③ ; (3) 。
20.(每空2分,共14分)(1) ;(2) , ;(3) ;(4) ;(5) , 。
四.填空题(每空2分,共34分)
21.(2分)(1) ;
22.(6分)(1) ;(2) ; (3) ;
23.(14分)(1) 、 、 、 、 。
(2) ;(3)
24.(6分)(1) ; ;(2)
25.(6分) 、 、 。
五.计算题 (共19分)
26.(8分)
27.(共11分)