高一化学第一学期期末考试2
试卷
考试时间:90分钟 共 8 页
本试卷可能用到的原子量:H-1 C-12 O-16 S-32 Na-23 Al-27
Mg-24 Cl-35.5 Cu-64 N-14 Fe-56 Ba-137
一、选择题(每小题只有一个正确选项符合题意,每题2分,共20分)
1.在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后 ( )
A.溶液为紫色 B.汽油层呈橙色
C.汽油层呈紫红色 D.溶液为橙色
2.卤素单质(从氟到碘)性质的递变规律正确的是 ( )
A.密度逐渐减小,颜色逐渐加深 B.氧化性逐渐减弱
C.还原性逐渐减弱 D.与氢化合条件逐渐困难
4.某种原子X的质量为a g,12C原子质量为b g,阿佛加德罗常数用NA表示,则X原子的相对原子质量在数值上等于 ( )
A.aNA B.12b/a
C.a/NA D.1.2a/b
5.下列区别HCl和Cl2的方法可行的是 ( )
A.AgNO3溶液 B.干燥的蓝色石蕊试纸
C. 润湿的碘化钾淀粉试纸 D.Ba(OH)2溶液
6.下列物质属于纯净物的是 ( )
A.氯水 B.小苏打
C.漂白粉 D.磷在氯气中的燃烧产物
7.设NA代表阿伏加德罗常数,则下列说法中不正确的是 ( )
A.23 g Na变成Na+时失去的电子数为NA
B.体积为11.2L的氯气中所含的氯原子数为NA
C.在常温常压下,金属从盐酸中置换出0.5 mol H2,发生转移的电子数为NA
D.在标况下,22.4L由氢气和氮气组成的混合气体中,所含分子总数为NA
8.下列物质的性质比较正确的是 ( )
A.溶解性:NaHCO3>Na2CO3 B.还原性:HCl>HBr>HI
C.热稳定性:Na2CO3>NaHCO3>H2CO3 D.氧化性:KCl>NaCl>LiCl
9.盐酸所具有的性质 ( )
A.有酸性有氧化性无还原性 B.有酸性,有还原性,无氧化性
C.只有酸性无氧化性无还原性 D.有酸性有氧化性有还原性
10.下列物质与其用途相符合的是 ( )
① Cl2—做消毒剂 ② AgBr—制胶卷,感光纸 ③ AgI—人工降雨
④ 碘—预防甲状腺肿大 ⑤ 淀粉—检验I2的存在 ⑥ NaClO—漂白纺织物
A.②③④⑤⑥ B.①②③④⑤
C.②③④⑤ D.全部
二、选择题(本题包括15小题,每小题2分,共30分。每小题有一个或两个选项符合题意)
11.下列各组混和气体通入水后,其中有一种气体消失,另一种气体增多的是 ( )
A.HCl和CO2 B.F2和O2
C.H2和Cl2 D.H2和HCl
12.向含有KBr和KI的混和溶液中通入过量氯气,然后把溶液蒸干,并将剩余残渣灼烧,最后留
下固体是 ( )
A.KCl B.KCl和KBr的混和物
C.Br2 D.I2和KCl
13.二氧化锰和浓盐酸共热时,当生成标况下的氯气2240 mL时,则被氧化的氯化氢的质量是( )
A.36.5 g B.73 g
C.109.5 g D.以上都不对
14.对于反应2 Na2O2 + 2 CO2 = Na2CO3 + O2↑,下列说法正确的是 ( )
A.Na2O2既是氧化剂又是还原剂 B.CO2是还原剂,Na2O2是氧化剂
C.反应中转移2mol电子 D.O2既是氧化产物又是还原产物
15.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是 ( )
① Cl2+2KI=I2+2KCl ② 2FeCl3+2HI=I2+2FeCl2+2HCl
③ 2FeCl2+Cl2=2FeCl3 ④ I2+SO2+2H2O=2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
16.在天平两托盘上分别放置盛有0.6 mol/L盐酸500mL的大烧杯,然后加入等质量的钠和镁,下列说法错误的是 ( )
A.若盐酸都过量,则天平保持平衡 B.不可能产生等质量的氢气
C.若盐酸都不足,则放镁这端重 D.镁的物质的量一定小于钠的物质的量
17.下列关于氯水的叙述正确的是 ( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡放出,该气体是Cl2
D.氯水放置数天后pH值将变小
18.在标准状况下,将11.2 LCO2和N2的混合气体通入足量Na2O2,气体体积变为8.4L(标准状况),则参加反应的Na2O2是 ( )
A.9.75 g B.11 g
C.14 g D.19.5 g
19.某温度下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl,则反应前后容器中压强比应接近 ( )
A.1∶11 B.11∶1
C.7∶11 D.11∶7
20.下列各组离子在溶液中能大量共存的是 ( )
A.K+、NO3-、Ag+、SO42- B.HCO3-、Ca2+、Cl-、OH-
C.Fe3+、SO42-、Mg2+ 、H+ D.Al3+、S2-、H+、Cu2+
21.在密闭容器中,盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得盐酸的质量分数为25.26%,则容器中原有H2、O2、Cl2的物质的量之比是( )
A.6∶3∶1 B.9∶4∶1
C.13∶6∶1 D.10∶6∶1
22.某NaOH溶液中,Na+离子和水分子个数比为1:20,则该NaOH溶液的物质的量浓度是(溶液的密度为1.15 g/cm3) ( )
A.0.288 mol/L B.2.88 mol/L
C.10% D.28.8%
23.有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中,得 到无色透明溶液,把溶液分成两份,向一份加入盐酸化的BaCl2溶液,出现白色沉淀,另一份加入HNO3酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是 ( )
(1) 原气体中肯定有SO2 (2)原气体中可能有SO2 (3)原气体中肯定没有H2S、HBr
(4) 不能肯定原气体中是否有HCl (5) 原气体中肯定没有CO2 (6) 原气体中肯定有HCl
A.(1)(3)(4) B.(2)(4)(5)
C.(1)(3)(6) D.(1)(3)(5)(6)
24.根据下列反应:
(1)FeCl3+2HI=2FeCl2+I2+2HCl
(2)2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O
(3)2FeCl2+Cl2=2FeCl3
若要从含有Fe2+、I-、Cl-的混合溶液中,只除去I-,而Fe2+和Cl-不被氧化,应向混合溶液中加入 ( )
A.KMnO4 B.Cl2
C.FeCl3 D.HCl
25.在50 g含1.17 gNaCl和0.84 gNaF的溶液中,加入过量的AgNO3溶液,充分搅拌,静置、过滤、干燥、称量得到0.02mol某种固体,由此可得出的正确结论是 ( )
A.只有一部分NaCl溶液参加反应
B.只有一部分NaF参加反应
C.氟化银难溶于水
D.氟化钠与硝酸银在溶液中无沉淀析出
三、填空题(共22分)
26.卤族元素包括___________等元素,卤族元素原子结构的共同点是__________________,不同点是________________________,其中氧化性最强的单质是_________,试举出两个化学性质说明它是最活泼的非金属元素__________________________, ____________________________。
27.往硫酸铜溶液中加入少量的过氧化钠粉末,观察到的现象是: ;
有关反应离子方程式是 和 。
28.在化学反应 2FeBr2+3Cl2=2FeCl3+2Br2中,被氧化的元素是_____________,被还原的元素是_____________氧化剂是_____________还原剂是_____________。用“双线桥”标出电子转移的方向和总数。
29.按下列要求各写一个化学反应方程式:
(1)氯元素被氧化_______________________________________
(2)氯元素被还原_______________________________________
(3)氯元素既被氧化又被还原_______________________________________
(4)氯元素既未被氧化又未被还原_______________________________________
四、物质推断题(本题共10分)
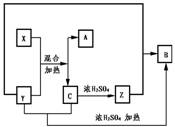 30.右图表示某些物质间的反应关系。已知无色晶体X和黑色固体Y 混合共热是实验室制备气体A的常用方法,黑色固体Y和Z的浓溶液共热也是实验室制备气体B的常用方法,已知X和C做焰色反应均出现紫色火焰,(隔着蓝色钴玻璃)试回答下列问题
30.右图表示某些物质间的反应关系。已知无色晶体X和黑色固体Y 混合共热是实验室制备气体A的常用方法,黑色固体Y和Z的浓溶液共热也是实验室制备气体B的常用方法,已知X和C做焰色反应均出现紫色火焰,(隔着蓝色钴玻璃)试回答下列问题
(1)填写化学式:
X Y
Z A
B C
(2)写出下列反应的化学方程式或离子方程式:
 Y+C+H2SO4(浓)
B(化学方程式):
Y+C+H2SO4(浓)
B(化学方程式):
X+C+H+ B(离子方程式):
高一化学期末试卷答卷
一、选择题(每题只有一个正确答案,每题2分,共20分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
二、多项选择题(每题有一个或二个选项符合题意,每小题2分,共30分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | 24 | 25 | |||||
| 答案 | ||||||||||
三、填空题(共22分,第26题6分,第27题6分,第28题6分,29题4分)
26.(1)卤族元素包括_________________________
(2)相同点
(3)不同点
(4)氧化性最强的单质是____________,
(5)两个化学性质__________________________,____________________________。
27.现象是 ;
有关反应离子方程式是
和 。
28.被氧化的元素是_____________,被还原的元素是_____________氧化剂是_____________还原剂是_____________。用“双线桥”标出电子转移的方向和总数:
2FeBr2+3Cl2=2FeCl3+2Br2
29. (1)氯元素被氧化_______________________________________
(2)氯元素被还原_______________________________________
(3)氯元素既被氧化又被还原_______________________________________
(4)氯元素既未被氧化又未被还原_______________________________________
四、物质推断题(共12分)
30.(1)填写化学式:
X Y Z
A B C
(2)写出下列反应的化学方程式或离子方程式:
 Y+C+H2SO4(浓)
B(化学方程式):
Y+C+H2SO4(浓)
B(化学方程式):
X+C+H+ B(离子方程式):
五、实验判断题(共6分)
31.某同学配制一定浓度的NaOH溶液时,如果出现下列情况,将会导致溶液的物质的量浓度如何变化?(填“偏高”“偏低”“不变”)
(1)所用的 NaOH已经潮解,则结果 ,
(2)溶解后,立刻进行定容,则结果 ,
(3)称量NaOH固体时,所用砝码已生锈,则结果 ,
(4)观察刻度时仰视刻度线,则结果 ,
(5)称量NaOH固体时,天平指针在“0”刻度线的左边,则结果 ,
(6)定容完毕,振荡摇匀时,有少量溶液溢出,则结果 。
五、计算题(共12分,第32题4分,第33题6分)
32.在标准状况下,1体积水中能溶解560体积的氨气,所得溶液的密度为0.9 g/cm3,求所得溶液的物质的量浓度。
33.将18.6克钠、氧化钠、过氧化钠的混合物投入足量水中,放出的气体在标准状况下体积为3.36 L,该混合气体放电时恰好完全反应。求原混合物中钠、氧化钠、过氧化钠的物质的量之比。