高一化学第一学期期中考试4
高 一 化 学 试 卷
命题人:诸松渊 审核人:郁见行 校对人:江 霞
可能需要的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 K-39 Ca-40 P-31
一、选择题(每小题2分,共12分。每小题只有1个正确答案)
1.在①化合反应、②分解反应、③置换反应、④复分解反应四种基本反应类型中,可以生成水的是
A.只有②③ B.只有①④ C.只有 ①②④ D.①②③④
2.关于化学反应本质的下列叙述中,正确的是
A.在氧化还原反应中,非金属单质既可作氧化剂,又可作还原剂
B.阴离子只能失去电子被氧化,作还原剂
C.失电子越多的还原剂,其还原性越强
D.某元素从化合物变为单质时,该元素一定被还原
3.造纸厂常用氯气漂白纸浆,漂白后的纸浆用NaHSO3除去残留的氯气,有关反应式为:Cl2 + NaHSO3 + H2O = NaHSO4 + 2HCl 。在这个反应中,氧化产物与还原产物的物质的量之比为
A.2∶3 B.1∶1 C.2∶1 D.1∶2
4.下列说法正确的是
A.NaCl固体不导电,NaCl是非电解质
B.CO2的水溶液能导电,所以CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液或熔化时均不导电,所以它是非电解质
5.设NA为阿伏加德罗常数,下列说法不正确的是
A.2.3g金属钠变成钠离子时失去的电子数目为0.1 NA
B.32g氧气所含原子数目为NA C.17 g氨气所含电子数目为10NA
 D.在标准状况下,0.5 NA个氯气分子所占体积约是11.2L
D.在标准状况下,0.5 NA个氯气分子所占体积约是11.2L
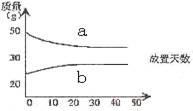
6. 浓硫酸和2mol·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图。分析a、b曲线变化的原因是
A、a升华、b冷凝 B、a挥发、b吸水
C、a蒸发、b结晶 D、a冷凝、b吸水
二、选择题(每小题3分,共36分。每小题有1到2个正确答案)
7.与0.2molH2O所含氢原子数相同的是
A.0.4molHNO3 B.0.1molH3PO4
C.3.01×1023H2SO4 D.0.2molH2SO4
8. 下列叙述中正确的是
A.在氧化还原反应中,非金属单质既可作氧化剂,又可作还原剂
B.阴离子只能失去电子被氧化,作还原剂
C.失电子越多的还原剂,其还原性越强
D.某元素从化合物变为单质时,该元素一定被还原
9.根据下列反应:(1)2ACl3+3B=2A+3BCl2(2)3DCl2+2A=2ACl3+3D(3)BCl2+C=CCl2+B,判断A、B、C、D的还原性由强到弱的顺序是
A.A>B>C>D B.D>C>B>A C.C>B>A>D D.B>A>C>D
10.用特殊方法把固体加工到纳米级(直径为1~100nm)的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种超细粉末粒子具有相同数量级的是
A.溶液 B.悬浊液 C.乳浊液 D.胶体
11.把少量氯水加入KI溶液中振荡,再加入四氯化碳振荡,静置后观察到的现象是
A.形成均匀的紫红色 B.有紫色沉淀析出
C.液体分层,上层是紫红色 D.液体分层,下层紫红色
12.下列各组物质的性质比较中,正确的是
A.热稳定性:Na2CO3 > NaHCO3 > H2CO3
B.熔点:Cl2 > Br2 > I2
C.溶解度:H2CO3 > NaHCO3 > Na2CO3
D.氧化性:K+ > Na+ > H+
13.在同温同压下,质量为m g的A气体和质量为n g的B气体所含的分子数相同。下列说法错误的是
A.A和B的摩尔质量之比为 n : m
B.同温同压下,同体积A和B的质量之比为 m : n
C.同温同压下,等质量A和B的体积之比为 n : m
D.同温同压下,A和B的密度之比为 m : n
14.下列离子中,电子数大于质子数且质子数大于中子数的是
A、D3O+ B、Na+ C、OD¯ D、OH¯
15.下列各组中的两物质作用时,反应温度或反应物用量的改变,对生成物没有影响的是
A.Na2O与H2O B.Na与O2 C.NaOH与CO2 D.C与O2
16.将一小块金属钠投入饱和澄清石灰水中,不可能观察到的现象是
A.钠熔成小球在液面游动 B.产生无色无味气体
C.产生白色浑浊 D.溶液由无色变红色
17.Na2O2是一种重要的氧化剂,氧元素的化合价为—1价。在下列反应中,Na2O2只表现出强氧化性的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.Na2O2 + MnO2 = Na2MnO4
C.Na2O2 + SO2 = Na2SO4
D.2KMnO4 +5Na2O2 +8H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 5O2↑ + 8H2O
18.由CH4和CO组成的混合气体,在标准状况下的密度为1 g·L-1,则混合气体中CH4和CO的物质的量之比约为
A.1∶1 B.1∶2 C.2∶3 D.7∶8
三、实验题(化学方程式和20(3)每格2分,其余每格1分。共15分)
19.(6分)物质的分离提纯是化学实验研究常用的方法。仿照所给例子填写下表中空格。
| 分离提纯实例 | 物质性质差异 | 分离方法 |
| 分离汽油和水 | 互不相溶 | 分液 |
| 用四氯化碳提取碘水中的碘单质 | 在不同溶剂中溶解度的差异 | 萃取 |
| 分离乙二醇(沸点198℃)和丙三醇(沸点290℃) | 沸点的差异 | 蒸馏 |
| 从含有氯化钠的硝酸钾溶液中提取硝酸钾 | 溶解度随温度变化的差异 | 结晶 |
20.(7分)将明矾(KAl(SO4)2·12H2O)溶解于水,用简便方法证明:
(1)溶液中存在K+离子:取样进行焰色反应 ,火焰呈 紫 色。
(2)溶液中存在SO42-离子:取样加入酸性 氯化钡 溶液,生成不溶于稀盐酸的 白色沉淀。有关的化学方程式是 KAl(SO4)2+2BaCl2=KCl+AlCl3+2BaSO4↓ 。
(3)生成Al(OH)3胶体: 取样置于烧杯中,用聚光手电筒照射有光路出现 。
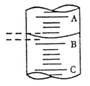 21.(2分)(1)量筒是化学中常用的计量仪器。一量筒中的液面位置如图所示,A与B、B与C刻度读数均相差1(mL),如果刻度A为8,量筒中溶液的体积是 7.2 mL。
21.(2分)(1)量筒是化学中常用的计量仪器。一量筒中的液面位置如图所示,A与B、B与C刻度读数均相差1(mL),如果刻度A为8,量筒中溶液的体积是 7.2 mL。
(2)配制物质的量溶液时需要使用容量瓶。若在定容过程中观察液面时俯视,会使所配制的溶液浓度 偏高 (偏高、偏低、无影响)。
四、填空题(共41分)
22.(4分)有一些非金属氧化物不能与碱发生反应。
(1)举出不能与碱发生化学反应的1种非金属氧化物。它的化学式是CO 。
(2)该非金属氧化物可以与其它物质发生化学反应,写出其中一个化学反应方程式 。
(3)有1种氧原子中的核内中子数为10,用![]() X的形式表示这种氧原子
。
X的形式表示这种氧原子
。
23.(3分)0.5molH2SO4的质量是49 g,其中含有 0.5 mol S原子、 2NA 个氧原子。
24.(2分)在一定温度和压强下,10体积气体A2跟30体积的气体B2化合生成20体积某气体C,则该气体C的化学式为(用A、B表示) AB3 。
25.(2分)将CaCl2溶解在1molH2O中,欲使Cl—与H2O分子的个数之比为1∶10,应取CaCl2的物质的量为 0.05mol 。
26.(化学方程式每格2分,其余每格1分,30分)饮用水质量是关于人类健康的重要问题。
(1)氯气是最早用于饮用水消毒的物质。其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的化学方程式为 。多余的氯气可用绿矾(FeSO4·7H2O)除去,反应过程中氯元素被还原、铁元素被氧化,该反应的化学方程式为 。
(2)氯气的工业生产通常采用电解食盐水的方法。写出电解食盐水的化学方程式,并在方程式上用双线桥标出电子转移的方向和数目。
(3)实验室制取氯气可采用浓盐酸与二氧化锰反应,还可用浓盐酸与高锰酸钾在常温下反应:2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 ↑+ 8H2O。在后一反应中,氧化剂是 ,氧化产物是 , 被氧化,若有0.1mol KMnO4参加反应,转移电子 0.5 mol,参加反应的HCl为 0.8 mol。你认为二氧化锰和高锰酸钾的氧化性哪个更强 高锰酸钾 。
(4)新制备的氯水显 色,说明氯水中有 分子存在,向氯水中滴入几滴AgNO3溶液,立即有 生成,说明氯水中有 存在。蓝色石蕊试纸遇到氯水后,首先变红,很快又褪色,这是因为 ,氯水经光照后,黄绿色逐渐消失,并放出无色的 气,该反应的化学方程式为 。
(5)使用氯气对饮用水消毒,会使水中的有机物发生氯代,生成含氯有机化合物,对人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用具有强氧化性的广谱性高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用稀有气体稀释,避免光照、振动或加热。
①在ClO2分子中,氯元素的化合价是 。
②欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2体积的一半。表示这一反应的化学方程式是 。
③我国广泛采用经干燥空气稀释的氯气,通入填有固体氯酸钠(NaClO3)的柱内制得ClO2,这一反应的化学方程式是 。
(6)The chemistry character of Cl2 is similar to Br2 and I2,please write out the chemical equation :
①Add Br2 into KOH (aq): 。
②The reaction of I2 and H2O: 。
五、计算题(共16分)
27.(7分)已知Na3PO4是电解质,在水溶液中电离成Na+和PO43-。
(1)写出Na3PO4在水溶液中的电离方程式。
(2)若将164g Na3PO4溶于水后配成500mL溶液,则溶液中Na+的物质的量浓度为多少?
28.(9分)—块表面被氧化为Na2O的金属钠质量为14.6g,投入到35.9g水中,产生标准状况下的氢气5.6L。试求:
(1)金属钠的纯度;
(2)生成NaOH的质量;
(3)所得溶液的质量分数。