高一化学第一学期期中考试试卷3
说明:请将第I卷选择题答案涂在答题卡上,第II卷答案做在答案纸上。
可能用到的相对原子质量:
H—1;C—12; O—16;Cl—35.5;Na—23; Mg —24;Al —27;Cu—64;Fe—56
(共50分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共20分)
1.下列物质能导电且为电解质的是
A.酒精 B.K2SO4晶体 C.熔化的NaCl D.Cu
2.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl
溶液,振荡后静置,现象正确的是
A.Ⅰ中溶液分层,下层呈紫红色 B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色 D.Ⅳ中溶液不分层,溶液呈无色
3.下列可以大量共存且溶液是无色的离子组是
A.H+、Na+、NO3-、MnO4- B.Fe2+、Mg2+、Cl-、SO42-
C.H+、K+、OH-、NO3- D.NO3-、SO42-、K+、Mg2+
4.下列说法中正确的是
A.溶液和胶体的本质区别是当一束强光通过胶体时,可出现一条光的通路,溶液则没有此现象
B.制备氢氧化铁胶体的方法是将饱和FeCl3溶液加热煮沸
C.凡是均一、透明的液体都是溶液
D.用滤纸不能分离胶体中的分散剂和分散质
5.下列离子方程式书写正确的是
A.钠与硫酸铜溶液反应: Na+Cu2++2H2O==Cu(OH)2↓+Na++H2↑
B.碳酸钡与稀盐酸反应: CO32-+2H+== CO2↑+H2O
C.醋酸与氢氧化钾溶液反应:CH3COOH+OH-== CH3COO-+H2O
D.硫酸镁与氢氧化钡溶液混合:Ba2++SO42-== BaSO4↓
6.下列反应中,不属于氧化还原反应的是
A.3CuS+8HNO3 = 3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Na2O2(熔融)+Fe2O3=2 Na2FeO4+Na2O
C.2KMnO4+5H2O2 +3H2SO4 = K2SO4+2MnSO4+5O2↑+8H2O
D.2Na2O2+H2SO4 = Na2SO4+H2O2
7.下列有关气体体积的叙述中,正确的是
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体的摩尔体积是指1mol任何气体所占的体积为22.4L
8.碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于HCl,转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解28.4g的上述混合物,消耗1.0 mol/L盐酸500mL。灼烧等量的上述混合物,得到氧化铜的质量为
A.35g B.30g C.20g D.15g
9.下列物质必须隔绝空气保存的是
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2SO4
A.①②③④⑤ B.①②③④ C.①③ D.①③④
10.向200mL0.1mol/L的FeCl2溶液中加入适量NaOH,使Fe2+恰好完全沉淀,小心加热此混合物,经足够长时间后,恢复至室温,过滤得沉淀物,对该沉淀物进行灼烧至质量不再变化时,此固体质量为
A.1.44g B.1.60g C.3.20g D.2.14g
二、选择题:(每小题可能有1~2个正确答案,每小题3分,共30分)
11.下列说法正确的是
A.氧化还原反应的实质是电子的得失或偏移
B.若元素的化合价处于最高价态,则一定具有强氧化性
C.反应中氧化剂得电子,还原剂失电子
D.越难得电子的粒子,越易失去电子
12.配制一定物质的量浓度的某溶液,下列情况会使配制结果偏高的是
A.未冷却即转移、定容 B.容量瓶中原来含有少量蒸馏水
C.未洗涤烧杯和玻璃棒 D.定容时俯视刻度线观察液面
13.NA代表阿伏加德罗常数,以下说法正确的是:
A.62g Na2O溶于水后,所得溶液中含有O2—数为NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.同温同压下,相同体积的任何气体单质所含的原子数相同
D.2.7 g金属铝变为铝离子时失去的电子数为 0.3NA
14.相同物质的量的KClO3分别发生下述反应:
①有MnO2 催化剂存在时,受热分解得到氧气;
②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl。
下列关于①和②说法不正确的是
A.都属于氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量相同
15. “可燃冰”的主要成分是甲烷与水分子(CH4·xH2O)。据测定每1 m3这种晶体可释放出140 m3的甲烷气体(假设气体体积已折算为标准状况,可燃冰的密度近似为1 g/cm3),试推算该“可燃冰”中,CH4与H2O分子个数比
A.1 :6 B.1 :7 C. 1 :8 D.1 :9
16.有下列氧化还原反应:
① Fe+CuSO4==Cu+FeSO4
② Cu+2FeCl3==CuCl2+2FeCl2
③ 2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O
④ 2FeCl2+Cl2==2FeCl3
根据上述反应可判断各粒子氧化性由强到弱的顺序正确的是
A.
MnO![]() >Cl2>Fe3+>Cu2+>Fe2+
B. Cl2>MnO
>Cl2>Fe3+>Cu2+>Fe2+
B. Cl2>MnO![]() >Cu2+>Fe2+>Fe3+
>Cu2+>Fe2+>Fe3+
C.
MnO![]() >Fe3+>Cu2+>Cl2>Fe2+ D. Fe3+>MnO
>Fe3+>Cu2+>Cl2>Fe2+ D. Fe3+>MnO![]() >Cl2>Cu2+>Fe2+
>Cl2>Cu2+>Fe2+
17.下列关于氧化钠和过氧化钠的叙述中,正确的是
A.都属于碱性氧化物 B.都能与水发生化合反应
C.水溶液的成分相同 D.与二氧化碳反应生成不同的盐
18.V L浓度为0.5mol/L的盐酸,欲使其浓度增大一倍,采取的合理措施是
A.通入标准状况下的HCl气体11.2V L
B.加入10mol/L的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩至0.5V L
D.加入V L1.5 mol/L的盐酸混合均匀
19.已知 20mL 含有0.05mol/L的R2O72—溶液恰好能将20mL浓度为 0.3mol/L的Fe2+
完全氧化,则元素R在还原产物中的化合价为
A .+2价 B.+3价 C.+4价 D.+5价
20.18g某混合气体通过足量的Na2O2 固体,充分反应后固体增重2g,则该混合气体不可能是
A.H2O(g)、O2 B.CO2、H2O(g)
C.CO2、H2 D.CO2、H2O(g)、O2
第II卷 (共计50分)
三、填空题:(共18 分)
21.(1)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,
写出反应的离子方程式: 。
在以上溶液中,继续滴加NaHSO4溶液,写出反应的离子方程式:
。
(2) 按要求写出离子的反应方程式:
① CaCO3+( )== ( ) +CO2↑+H2O
②( )+OH—== H2O +CO32-
③ Al2O3 +( )== 2Al O 2- +H2O
22.世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧州和我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同时会产生Cl2。该法制ClO2的化学方程式为
2NaClO3+4HCl == 2ClO2↑+Cl2↑+2NaCl+2H2O
(1)若生成0.1mol Cl2,转移的电子的物质的量为 ,该反应中氧化产物为 。
(2)盐酸在反应中显示出来的性质是:(填写编号) 。
①只有还原性 ②具有还原性与酸性 ③只有氧化性 ④具有氧化性和酸性
23.(1)分别取m g Na、Mg、Al与足量的盐酸反应,在相同条件下产生的氢气的体积比是 。
(2)若产生相同体积(同温同压下)的氢气,所需Na、Mg、Al 三种金属的物质的量之比是 。
(3)若将0.2 mol Na 、Mg、Al分别投入20 mL1mol/L的盐酸中,在标准状况下,产生的氢气的体积大小顺序是 。
四、实验题(共18分)
24.根据下图所示的转化关系及现象填空(假设每一步反应的反应物均恰好反应完):


(1)反应①中,当有3.2 g气体产生时,消耗淡黄色固体的物质的量是__________;
固体增重__________克
(2)反应②、③、④的离子方程式为:
② _____________________________________________
③_____________________________________________
④_____________________________________________
25.实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
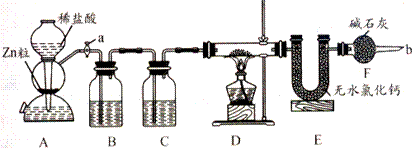
(1)如何检查装置A的气密性。_________________________________________
(2)为了安全,在点燃D处的酒精灯之前,在b处必须_____________________。
(3)装置B 的作用是_______________ ,装置C中装的液体是________________,所起的作用是_______________________。
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是________________________________________。
(5)若FeO和Fe2O3固体混合物的质量为23. 2g,反应完全后,U型管的质量增加7.2g则混合物中Fe2O3的质量为______________。
(6)U型管E右边连接干燥管F的目的是______________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”、“偏小”或“无影响”)
(7)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将__________(填“偏大”、“偏小”或“无影响”)。
五、计算题:(共14分)
26.可能由CO、CO2和O2组成的混合气体30mL,通过足量的Na2O2,经充分反应后,气体体积变为25mL,引燃剩余气体,恢复到原温度,测得气体体积变为20mL(气体体积均为相同条件下测得)。试通过计算确定原混合气体中有无O2?体积是多少?

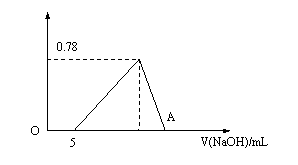 27.向20mL盐酸和氯化铝的混合溶液中,逐滴加入2mol/L NaOH溶液,生成沉淀的质量与NaOH溶液的体积关系如图所示。
27.向20mL盐酸和氯化铝的混合溶液中,逐滴加入2mol/L NaOH溶液,生成沉淀的质量与NaOH溶液的体积关系如图所示。
(1)求原溶液中Al3+和Cl-的物质的量浓度分别是多少?
(2)求A点处NaOH溶液的体积为多少mL?
 第一学期期中考试
第一学期期中考试
高一化学答题纸
三、填空题:(共18 分)
21、(1) 。
。
(2)按要求写出离子的反应方程式:
① CaCO3+( )== ( ) +CO2↑+H2O
②( )+OH—== H2O +CO32-
③ Al2O3 +( )== 2Al O 2- +H2O
22、(1) ; 。
(2)(填写编号) 。
23、(1) 。
(2) 。
(3) 。
四、实验题(共18分)
24、(1)_______________;_________________克
(2)反应②、③、④的离子方程式为:
② _____________________________________________
③_____________________________________________
④_____________________________________________
25、(1)__________________________________________________________________
__________________________________________,
(2)_____________________。
(3) __________________ ,_________________, _________________。
(4)______________________________________________________________。
(5)_____________。
(6)__________________________, _____________(填“偏大”、“偏小”或“无影响”)。
(7)_______________(填“偏大”、“偏小”或“无影响”)。
五、计算题:(共14分)
26、(1)
(2)
27、(1)
(2)
高一化学答案:
1、 A2、B3、D4、D5、C6、D7、B8、C9、B10、B11、AC12、AD13、BD14、D15、C16、A17、C18、B19、B20、AB
21、(1)Ba2++OH—+ H++SO42-= BaSO4↓+H2O OH—+ H+= H2O
(2)① CaCO3+( 2H+ )== ( Ca2+ ) +CO2↑+H2O
②( HCO3- )+OH—== H2O +CO32-
③ Al2O3 +( 2OH— )== 2Al O 2- +H2O
22、(1)0.2mol Cl2 (2) ②
23、(1)1/23:1/12:1/9 (2)6:3:2 (3)Na>Mg=Al
24、(1)0.2mol 5.6g(2)CuO+2H+=Cu2++H2O Ca2++CO32—=CaCO3↓
Cu2++2OH—=Cu(OH)2↓
25、(1)略(2)验纯(3)除HCl、浓H2SO4、除水蒸气
(4)Fe2O3+3H2=2Fe+3H2O FeO+H2=Fe+H2O
(5)16g(6)防止空气中水蒸气进入、偏大(7)偏小
26、讨论:(1)有10mlO2(2)无O2
27、(1)C(Al3+)=0.5mol/L C(Cl—)=2mol/L
(2)25ml