高一化学第二学期期中考试试卷
班别 姓名 座号 分数
一、选择题(本大题共20小题,每题只有一个答案正确,共80分)
1.下列关于原子的几种描述中,不正确的是( )
A.18O与19F具有相同的中子数 B.16O与17O具有相同的电子数
C.12C与13C具有相同的质量数 D.15N与14N具有相同的质子数
2.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+2 B.x+4 C.x+8 D.x+18
3.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的密度依次增大 B.单质的熔、沸点依次升高
C.Cl2可从KBr溶液中还原出Br2 D.F2可从NaCl溶液中还原出Cl2
4.下列氢氧化物中,碱性最强的是( )
A.KOH B.NaOH C.LiOH D.CsOH
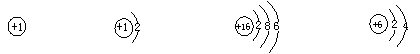 5.下列粒子结构示意图中不正确的是(
)
5.下列粒子结构示意图中不正确的是(
)
A.H+: B.H-: C.16O: D.14C:
6.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A.Al3+ B.Mg2+ C.Be2+ D.H+
7.某元素的最高正价与负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
8.下列物质中含有非极性键的共价化合物是( )
A.H2O2 B.CH3COONa C.Na2O2 D.I2
9.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
10.下列物质中,既含有离子键又含有共价键的是( )
A.H2O B.CaCl2 C.NaOH D.Cl2
11.能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源 C.电能是一级能源 D.水力是一级能源
12.燃烧相同质量的氢气,生成液态水放出热量为Q1,生成气态水放出热量为Q2,则Q1和Q2的关系是( )
A.相等 B.大于 C.小于 D.无法确定
13.下列变化中属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
14.铜片和锌片用导线连接后插入稀H2SO4中,锌片是( )
A.阴极 B.正极 C.阳极 D.负极
15.在用Zn片、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
A.锌片是正极,铜片上有气泡产生 B.电流方向是从锌片流向铜片
C.溶液中H2SO4的物质的量减少 D.电解液的pH保持不变
![]() 16.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为2Ag+Zn(OH)2 Ag2O+Zn+H2O,此电池放电时,负极上发生反应的物质是( )
16.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为2Ag+Zn(OH)2 Ag2O+Zn+H2O,此电池放电时,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
![]() 17.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和 1 2O2+H2O+2e-=2OH-,则下列叙述正确的是( )
17.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和 1 2O2+H2O+2e-=2OH-,则下列叙述正确的是( )
A.通H2的一极是正极,通O2的一极是负极 B.通O2的一极是正极,通H2的一极是负极
C.工作一段时间后电解质溶液的pH增大 D.工作时负极区附近pH增大
18.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
![]() 19.反应2SO2+ O2
2SO3 经一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
19.反应2SO2+ O2
2SO3 经一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
A.0.1s B.2.5s C.5s D.10s
![]() 20.反应4NH3(g)+5O2 (g) 4NO(g)+6H2O(g)
在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(x)(反应物的消耗速率或产物的生成速率)可表示为( )
20.反应4NH3(g)+5O2 (g) 4NO(g)+6H2O(g)
在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(x)(反应物的消耗速率或产物的生成速率)可表示为( )
A.υ(NH3)=0.010mol·L-1·s-1 B.υ(O2)=0.0010mol·L-1·s-1
C.υ(NO)=0.0010mol·L-1·s-1 D.υ(H2O)=0.045mol·L-1·s-1
二、填空题(本大题共5小题,共40分)
21.(10分)现有失去标签的A、B、C、D、E五个集气瓶,分别充满H2、O2、Cl2、HCl、HBr五种气体中的一种,其中C是黄绿色,A、C混和见光爆炸,C、D混和在瓶壁上出现橙红色小液滴,E遇潮湿空气出现白雾,则:A 、B 、C 、D 、E 。
22.(4分)X、Y、Z是周期表中相邻的三种元素,其中X、Y同主族,Y、Z同周期。此三种元素原子最外层电子数总和为16,质子数总和为38。则X、Y、Z分别是 。
23.(12分)用“>”或“<”回答下列问题:
(1)酸性:H2CO3 H2SiO3, H2SiO3 H3PO4
(2)碱性:Ca(OH)2 Mg(OH)2, Mg(OH)2 Al(OH)3
(3)气态氢化物稳定性:H2O H2S, H2S HCl
(4)还原性: H2O H2S, H2S HCl
(5)酸性: H2SO4 H2SO3, HClO4 HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越 ;
| X | ||
| Y | Z |
②元素的金属性越强,其对应最高价氧化物水化物的碱性越 。
24.(6分)X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示,已知X、Y、Z三元素的质子数之和为31,试回答:
(1)X原子的电子式为 。
(2)Y的最高价氧化物的电子式 。
(3)Z的单质与盐酸反应的化学方程式 。
25.(8分)科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作。回答下列问题。
(1)正极材料是 ,电极反应是 。
(2)负极材料是 ,电极反应是 。
三、计算题(本大题共2小题,共30分)
26.(12分)实验室用铅(Pb)蓄电池作电解饱和食盐水制氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO2-4-2e-=PbSO4
正极:PbO2+4H++SO2-4+2e-=PbSO4+2H2O
若今制得Cl20.050mol,这时电池内消耗的硫酸的物质的量至少是多少?
27.(18分)把Cl2通入含11g NaBr的溶液中,充分反应后将溶液蒸干,得6.55g残渣,通过计算回答NaBr是否完全反应?生成的NaCl为多少克?


 第二学期期中考试
第二学期期中考试
高一化学试卷答题卡
| 题号 | 一 | 二 | 三 | 总分 |
| 得分 |
| 评卷人 | 得分 |
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 评卷人 | 得分 |
二、填空题
21.A B C D E
22.
23.(1) , (2) , (3) , (4) , (5) ,
① ②
24. (1) (2) (3)
25. (1) ,
(2) ,
| 评卷人 | 得分 |
三、计算题
26.
27.