高一化学第二学期期中考试试卷
班级_______ 姓名_______ 学号_______
可能用到的原子量:H—1;O—16;Na—23;S—32
第Ⅰ卷(50分)
一. 选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意。)
1. 下列化学式能真实表示物质分子的组成的是: ( )
A.K2S B.SiO2 C.H2SO4 D.Na2O
2.元素的化学性质主要决定于原子的 ( )
A 质子数 B 中子数
C 核外电子数 D 最外层电子数
3.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是 ( )
A 13C与15N有相同的中子数
B 13C与C60互为同素异形体
C 15N与14N互为同位素
D 15N的核外电子数与中子数相同
4.X元素的阳离子和Y元素的阴离子具有相同的核外电子结构,下列叙述中正确的是 ( )
A 原子序数X<Y B 原子半径X<Y
C 离子半径X>Y D 原子最外层电子数X<Y
5.下列化工生产过程所发生的反应不属于氧化还原反应的是 ( )
A.用饱和食盐水制纯碱 B.用融熔食盐电解制金属钠
C.用氯气和消石灰制漂白粉 D.用氢气和氯气合成盐酸
6.下列电子式错误的是 (
)
A.![]() B.
B.![]()
C.![]() D.
D.![]()
7.配制波尔多液和石硫合剂、制取漂白粉以及改良酸性土壤时,都要用到的物质是 ( )
A石膏 B熟石灰 C胆矾 D硫磺
8.下表给出几种氯化物的熔沸点,对此有下列说法:
①CaCl2属于离子晶体 ②SiCl4是分子晶体 ③1500℃时,NaCl可形成气态 分子
④MgCl2水溶液不能导电
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1465 | 1418 | 1600 | 57 |
与表中数据一致的说法有 ( )
A.仅① B.仅② C.①和② D.①、②和③
9.将1g氢气和4g氧气混合点燃,放出71.45KJ热量,同样条件下1摩氢气在氧气中完全燃烧放出的热量是 ( )
A.71.45KJ B.142.9KJ C. 285.8KJ D. 571.6 KJ
10.下列对SO2和SO3的叙述正确的是 ( )
A.通常条件下,都是无色气体,都易溶于水
B.都能跟碱液反应
C.都可使品红溶液褪色,加热时红色又能再现
D.都是酸性氧化物,其水溶液都是强酸
二. 选择题(本题包括10小题,每题3分,共30分。每小题只有一到两个选项符合题意。)
11. 向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A NaCl Na2SO4 B NaCl NaBr Na2SO4
C NaCl Na2SO4 I2 D NaCl NaI Na2SO4
12.下列物质中含有非极性键的化合物是 ( )
A、NaOH B、Na2O2
C、Cl2 D、CO2
13. 下列说法正确的是 ( )
A、 离子化合物中只能含离子键,不能有共价键
B、 由非金属元素形成的化合物一定是共价化合物
C、 电子数相同的两种微粒一定是同一元素
D、 判断化学变化的可靠方法是看有无化学键的变化
14、下列各组离子,在水溶液中不能以较大浓度共存的是 ( )
A Fe2+,H+,SO42-,Br- B Cu2+,K+,S2-,SO42-
C SO32-,H+,Cl-,NO3- D Na+,NH4+,NO3-,H+
15. 现在含有元素硒的保健品已开始进入市场.已知硒与氧同族与钾同周期,则下列关于硒的叙述中不正确的是 ( )
A.非金属性比溴强 B.最高价氧化物的化学式SeO3
C.原子序数为34 D.气态氢化物的化学式为H2Se
16.右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于 ( )
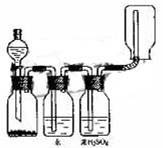 A 锌和盐酸发生氢气
A 锌和盐酸发生氢气
B 二氧化锰和浓盐酸生成氯气
C 碳酸钙和盐酸生成二氧化碳
D 氯化钠和浓硫酸生成氯化氢
17.以下有关接触法制硫酸的论述错误的是 ( )
A.为提高反应速度和原料利用率,黄铁矿要在“沸腾”状态下燃烧
B.为防止催化剂中毒,气体在进接触室前要先净化
C.接触室中热交换器其主要作用是预热未反应的气体和冷却反应后的气体
D.吸收塔中SO3从下而上,水从上而喷下,剩余气体从上部
18.实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,由此可判断BeCl2属于 ( )
A.由极性键形成的极性分子 B.由极性键形成的非极性分子
C.由非极性键形成的极性分子 D.由非极性键形成的非极性分子
19.已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论不正确的是
( )
A. 氯化铝是电解质
B. 固体氯化铝是分子晶体
C. 可用电解熔融氯化铝的办法制取金属铝
D. 氯化铝为非极性分子
20.对下列现象的解释中,错误的是 ( )
A、把锌粒放入稀硫酸中会产生H2,这是利用了硫酸的酸性
B、浓硫酸能使蔗糖炭化,这是浓硫酸强氧化性的体现
C、浓硫酸能做干燥剂是利用了浓硫酸的吸水性
D、SO2具有漂白性并非是因为它的氧化性
高一化学第二学期期中考试试卷
班级_______ 姓名_______ 学号_______
第Ⅱ卷(50分)
三.填空题
21.(7分)下列物质存放在敞口容器中,总质量有何变化(增大、减小、不变):
金属钠____________,NaOH固体_________, Na2CO3·10H2O__________,
浓硫酸____________,浓盐酸_____________, 石灰水________________,
NaCl溶液_________。
22.(8分)在原子序数为 1 — 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
(1)原子半径最大的是 ______ , 简单离子中, 离子半径最大的是 _____
(2)气态氢化物最稳定的是 _______ , 气态氢化物中含有H 元素质量分数最大的氢化物是________
(3)酸性最强的无氧酸是______, 碱性最强的是_______ ,酸性最强的含氧酸是 _________, 属于两性氢氧化物的物质是___________.
23.(5分) 为了保护环境,变害为利,工业上常用纯碱吸收有害气体,同时得到NaHSO3,该反应的离子方程式为_____________,从这一个反应可见H2SO3的酸性比H2CO3的酸性________;H2O2可作为脱氯剂使用,该反应的方程式为________________。
24.(5分) 某亚硫酸钠试剂已部分被氧化,为确定其纯度要进行如下实验:①称取样品m1 g;②将样品溶解;③给溶液加入稍过量盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称得其质量为m2 g。回答:
(1)BaCl2要用盐酸酸化的原因
。
(2)BaCl2溶液稍过量的目的
。
(3)判断(2)是否完成的方法是
。
(4)判断沉淀是否洗净的方法是
。
(5)Na2SO3纯度表示式为W(Na2SO3)
。
25(10分)有A、B、C、D 4种元素,它们的原子序数由A到D逐渐增大。①D的氧化物分子式为DO2,D的最高价氧化物中,D的质量百分含量为40%,而且D的原子核中,质子数和中子数相等,②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍;⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同。通常状况下,B的单质是气体,0.1摩B和H2完全反应时,有2.408x1023个电子转移,C的单质在高温下与B的单质充分反应,可生成浅黄色固体,此生成物与AB2反应可生成B的单质。根据以上叙述试回答:
(1)指出四种元素的名称:A_____,B_____,C_______,D______。
(2) 写出AB2的结构式_________;分子空间构型________,AB2晶体俗名叫________;是________晶体(原子、分子、离子)
(3)电子式表示B、C在高温下化合的过程______________
26.(4分) 下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回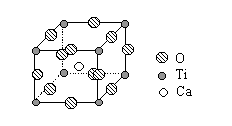 答:
答:
(1)该化合物的化学式为 。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个。
四.计算题
27.(5分)在氧气中燃烧0.4克硫和铁组成的化合物样品,使其中硫全部转化为SO2,又全部转化为硫酸,这些硫酸可以跟20毫升0.5摩/升的NaOH溶液完全中和,原化合物中硫的百分含量是多少?
28.(6分)有一亚硫酸钠,可能已经变质。现将亚硫酸钠试样烘干后,称取a克,用蒸馏水溶解,加足量硝酸钡溶液,滤出生成的沉淀,洗净、干燥,得沉淀b克,试写出下列三种情况b与a的关系式:
(1)当亚硫酸钠没有变质时:_____________
(2)当亚硫酸钠部分变质时:_____________
(3)当亚硫酸钠完全变质时:_____________
参考答案:
一.选择题
1-5 C.D.C.D.A 6-10 B.A.D.C.B
二.选择题
11-15 AB.B.D.BC.A 16-20 A.D.B.AC.B
三.填空题
21.增大;增大;减小;增大;减小;增大;不变
22.(1)Cl,Cl- ;(2)HF,CH4 ;
(3)HCl,NaOH,HClO4 ,Al(OH)3
23.CO32-+2SO2+H2O==CO2+2HSO32-;强;
H2O2+Cl2==2HCl+O2
24. (1)因为SO32-与Ba2+也可反应生成沉淀BaSO3,须用盐酸除去。
(2)尽可能将SO42-沉淀完全
(3)向上层清液中加少许BaCl2溶液,若仍有沉淀生成即尚未完成
(4)取洗涤液少许,滴加Na2SO4溶液(或AgNO3溶液),若有沉淀生成,则未洗干净。
(5)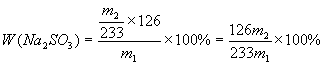
25.(1) A:碳,B:氧,C:钠,D:硫
(2)O=C=O,直线型,干冰,分子
![]()
![]()
![]() (3)2 +2
(3)2 +2
![]()
26.(1)CaTiO3 ;
(2)6
四.计算题
27.40%
28.(1) ![]() ;(2)
;(2)
![]() ;(3)
;(3) ![]()