高一化学第二学期期中试卷
(考试时间:120min,总分:150)
命题人:杨学军
可能用到的相对原子质量 H-1 C-12 N-14 O-16 S-32 Zn-65
( 第Ι卷 72分)
一、选择题(本题包括8小题,每题4分,只有一个正确选项,请把答案填入第Ⅱ卷相应的空格内)
1、2005年下半年,我国接连发生多起煤矿爆炸事故,造成重大人员伤亡和财产损失。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
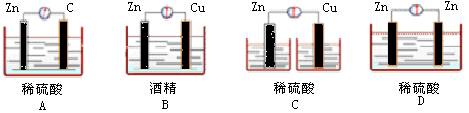
2、下图各装置中,能构成原电池的是
3、某烷烃含有200个氢原子,那么该烃的分子式是
A C97H200 B C98H200 C C99H200 D C100H200
4、下列各组物质中必定属于同系物的是
A. ![]() B.
B.
![]()
C、CH2=CH2和CH2=CH—CH=CH2 D. ![]() 和
和![]()
5、通常用来衡量一个国家石油化工发展水平的标志是
A、石油的产量 B、乙烯的产量
C、硫酸的产量 D、合成纤维的产量
6、下列事实能证明乙烯分子中含有一个碳碳双键的是
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1 mol C2H4完全加成消耗1 mol Br2
D.乙烯能使酸性KMnO4溶液褪色
7、有人设计了Pt和Zn为电极材料的电池埋入人体内作为某种心脏病人的心脏起搏器的能源,它依靠人体体液中含有一定浓度的溶解氧、H+ 和Zn2+ 进行工作,则
A. Pt作负极
B. 正极电极反应:2H++2e-=H2↑
C. 负极电极反应:O2+2H2O+4e-=4OH-
D. 正极电极反应:O2 + 4H+ + 4e-=2H2O
8、在下列过程中,需要增大化学反应速率的是
A.钢铁腐蚀 B.食物腐败
C.塑料老化 D.工业制SO2
二、选择题(本题包括10小题,每题4分,每题有一个或两个正确选项,请把答案填入第Ⅱ卷相应的空格内)
9、门窗紧闭的厨房内一旦发生煤气大量泄漏,极容易发生爆炸。当你从室外进入厨房嗅到极浓的煤气异味时,在下列操作中,你认为最合适的是
A.立即开启抽油烟机排出煤气,关闭煤气源 B.立即打开门和窗,关闭煤气源
C.立即打开电灯,寻找泄漏处 D.上述三者可同时进行
10、某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH溶液.该电池的总反应是
Zn+Ag2O=2Ag+ZnO,下列说法正确的是
A.Zn极为负极,其电极反应为:Zn+2OH--2e-=ZnO+H2O
B.Ag2O极为负极,其电极反应为:Ag2O+H2O-2e-=2Ag+2OH-
C.电池放电过程中,负极周围溶液的pH不断增大
D.该电池用完后,可作为普通垃圾处理,因为它不会造成环境污染
11、X、Y、Z三种元素原子的核电荷数在11—17之间。它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4 。则下列判断正确的是
A.最高正价:X>Y>Z
B.酸性:H3ZO4>H2YO4>HXO4
 C.稳定性:HX<HY<HZ
C.稳定性:HX<HY<HZ
D.非金属性:X>Y>Z
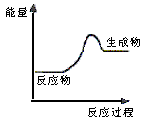
12、根据右图提供的信息,下列所得结论不正确的是
A 该反应中化学能转化成了热能,为放热反应
B 该反应一定有能量转化成了生成物的化学能
C 反应物比生成物稳定
D 因为生成物的总能量高于反应物的总能量,所以反应不需要加热
13、设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为![]() NA
NA
B.1 mol甲基(—CH3)所含的电子总数为7NA
C.0.5 摩1, 3-丁二烯(CH2=CHCH=CH2)分子中含有C=C双键数为 NA
D.1 mol碳正离子(CH![]() )所含的电子总数为8NA
)所含的电子总数为8NA
14、某烯烃与H2加成后的产物是![]() , 则该烯烃的结构式可能有
, 则该烯烃的结构式可能有
A 1种 B 2种 C 3种 D 4种
15、下列离子方程式正确的是
A.三氯化铝溶液中滴加过量的氢氧化钠溶液:Al3+ + 3OH— === Al(OH)3↓
B.向澄清石灰水中通入过量二氧化碳气体:OH— + CO2 === HCO3-
C.次氯酸钙溶液中通入二氧化碳:
Ca2++2ClO-+H2O+CO2 == CaCO3+2H++2ClO-
D.Cl2通入烧碱溶液中:Cl2+2OH-=ClO-+Cl-+H2O
16、在一定条件下,反应N2+3H2![]() 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A v(H2)=0.03mol/(L·min) B v(NH3)=0.01mol/(L·min)
C v(NH3)=0.17mol/(L·min) D v(N2)=0.02mol/(L·min)
17、下列哪种物质的中心原子的最外层不是8电子结构
A.CO2 B.NF3 C.PF5 D.OF2
18、短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
A、X与Y不可能位于同一主族
B、X与Y一定位于同一周期
C、X与Y可能形成共价化合物XY
D、X与Y可能形成离子化合物XY
请把选择题答案填入下列空格中
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||||
|
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
(第Ⅱ卷 78分)
三、(共6小题,38分)
19、(8分)门捷列夫提出元素周期律、画出第一张元素周期表,为化学研究和实践提供了一个不可缺少的工具,同时后来的化学家也对元素周期表不断地进行改进和完善。请根据你所学的知识回答下面有关问题:
(1)人们可以在金属与非金属分界线附近寻找 材料,
在 元素中寻找各种优良的催化剂。
(2)有人提议可将氢元素放在ⅦA族,他的理由是 ;根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族。
20、(6分)A、B、C、D、E是中学化学中常见的有10个核外电子的分子或离子,且A是由5个原子核组成的粒子,它们之间可以发生如下变化:A+B=C+D;B+E=2D,且D与酸性氧化物、碱性氧化物均能发生反应。请回答下列问题:
(1)写出A的电子式:__________;
(2)写出D的结构式:__________;
(3) 写出A+B=C+D的反应方程式:__ ___
21、(6分)烷烃分子可看成由-CH3、-CH2-、![]() 和
和![]() 等结合而成,如果某烷烃分子中这四种基团都存在,那么这个烷烃最少应有_____个碳原子,其结构简式可能为
等结合而成,如果某烷烃分子中这四种基团都存在,那么这个烷烃最少应有_____个碳原子,其结构简式可能为
___________________或____________________
或 。
| 座位号 |
22、(6分)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的极是原电池的 极,通O2的极的电极反应是 ,电池工作时的总反应的离子方程式是
。
23、(6分)右图表示800℃时,A、B、C三种气体物质的浓度随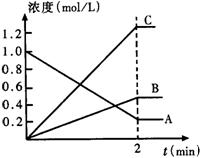 时间变化的情况,t表示时间。试回答:
时间变化的情况,t表示时间。试回答:
(1)该反应的反应物是 。
(2)该反应的化学方程式为 。
(3)达到平衡状态的所需时间是2min,A物质的平
均反应速率为
。
24、(6分)近20年来,对以氢气作为未来的动力燃料,氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1) 关于用水制取二级能源氢气,以下研究方向不可行的是 。
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢气成为二级能源
B.设法将太阳能聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气同时放出能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(2)燃烧氢气时耗氧量小,发热量大。已知热化学方程式为
C(g) + O2(g)= CO2 (g) △H= —393.5KJ/mol
H2 (g) + 1/2O2 (g)= H2O (l) △H= —285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是
(提示:在化学反应过程中放出或吸收的热量,通常叫做反应热,用符号
△H表示,单位一般采用KJ/mol。△H‹0时,为放热反应。)
四、实验题(两小题,共20分)
25、(10分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有_______________(填代号,限填3项)。
A、试管 B、瓷坩埚 C、坩埚钳 D、铁三角架
E、泥三角 F、洒精灯 G、烧杯 H、量筒
(2)第2步:碘离子溶液的获取。操作是
_________________________________________ 。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用_________(填代号)。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
理由是__________________________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显 色,则证明海带中含碘。
26、(10分)
(1)实验室分馏石油的正确操作顺序是E→_____→_____→A→_____→_____→G。
A.连接接液管
B.装入碎瓷片和石油,塞上带温度计的塞子
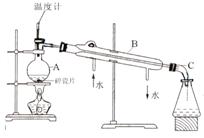 C.检查装置气密性
C.检查装置气密性
D.连接冷凝管及进出水管
E.在铁架台上放酒精灯,固定好铁圈,放上石棉网
F.固定好蒸馏烧瓶
G.加热
(2)以下是石油分馏的装置图,将指出有关仪器的名称:
A_____________、B_____________、C_____________。
(3)图中有3处错误,它们分别是:
①__________________________
②__________________________
③
(4)分馏石油得到的各个馏分都是___________(填“混合物”或“纯净物”)。
五、计算(两小题,共20分)
27、(8分)在铜片、锌片和200 mL稀硫酸组成的原电池中,若电路中通过0.3 mol e—,H2SO4恰好作用完毕。试计算:
(1)所消耗锌的质量;
(2)生成气体的体积(在标准状况下);
(3)原200 mL稀硫酸的物质的量浓度。
28、(12分)乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO到CO2的混合气体和45g水。试求: ⑴ 当a =1时,乙烯和乙烷的物质的量之比n (C2H4)∶n (C2H6)= 。
⑵ 当a =1,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b= ,得到的CO和CO2的物质的量之比n (CO)∶n (CO2)= 。
⑶ a的取值范围是 。
⑷ b的取值范围是 。
参考答案
第Ⅰ卷(选择题 共72分)
一、二选择题(共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | B | A | C | B | B | C | D | D | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | A | AD | AD | AB | C | BD | B | C | CD |
第Ⅱ卷(非选择题 共78分)
三、(本题包括6小题,共38分)
19.(8分)(1)半导体,过渡元素(副族和Ⅷ族)(4分)
(2)氢原子可以得到一个电子达到稳定结构(氢元素可以表现-1价),IVA (各2分)
20.(6分,每空2分)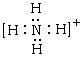 , H-O-H ,NH4++OH-==NH3+H2O
, H-O-H ,NH4++OH-==NH3+H2O
21、(6分,第一空1分,后三空共5分)8;写对1个得2分,2个得4分,3个得5分
22、(6分,每格2分) 负, O2 + 4e— +2H2O=4OH— , CH4+2O2 +2OH—=CO32—+2H2O
23、(6分,每格2 分)
(1)__ A __。
(2)__2A ![]() B +3C ___。 不配平、无可逆符号不得分
B +3C ___。 不配平、无可逆符号不得分
(3)_0.4 mol/(L·min) __。
24、(6分,每空3分)(1)A C (2)4.36 :1
四、(两小题,共20分)
25(10分)
(1) B E F
(2)将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅拌,煮沸,过滤
(3) D,过氧化氢是绿色氧化剂,在氧化过程中不引进杂质、不产生污染(不会进一步氧化单质碘)
(4)蓝
26、(10分)
(1)EFDACBG
(2)圆底烧瓶,冷凝管,
(3)温度计水银球应在烧瓶支管口附近;没有用石棉网;冷却水的方向通反了
五、(两小题,共20分)
27、(1)9.75g (2)3.36L (3)0.75mol/L(方程式2分,其余各2分)
28(12分)、⑴ 1∶1 ⑵ 3,1∶3
⑶ ![]() ⑷
⑷ ![]()