高一化学第二学期期终复习题一
(物质结构和元素周期律复习题)
一、选择题(每小题有一个或两个选项符合题意)
1.下列各组微粒,互称为同位素的是( )
A、![]() X和
X和![]() X B、
X B、![]() M和
M和![]() N C、
N C、![]() H+ 和D+ D、O2和O3
H+ 和D+ D、O2和O3
2.据最新科技报导,科学家发现了新型氢微粒,这种微粒是由3个氢原子核(只含质子)和2个电子构成。对于这种微粒,下列说法中正确的是( )
A、是氢的一种同素异形体 B、是氢的一种新的同位素
C、它比一个普通H2分子多一个氢原子 D、它的组成可用H3+表示
3.下列气态氢化物中最稳定的是 ( )
A、PH3 B、H2O C、NH3 D、CH4
4.据最新科技报导,科学家发现了新型氢微粒,这种微粒是由3个氢原子核(只含质子)和2个电子构成。对于这种微粒,下列说法中正确的是( )
A、是氢的一种同素异形体 B、是氢的一种新的同位素
C、它比一个普通H2分子多一个氢原子 D、它的组成可用H3+表示
5.下列分子中,属于含极性键的非极性分子的是( )(全国高考题)。
(A)H2O (B)Cl2 (C)NH3 (D)CCl4
6.下列各分子中所有原子都满足最外层为8电子结构的是( )(全国高考题)。
(A)光气(COCl2) (B)六氟化硫 (C)二氟化氙 (D)三氟化硼
7.含有相同质子数和电子数的两种微粒之间的关系不正确的是:( )
A.它们可能是同位素 B.可能是不同的分子
C.可能是不同的离子 D.可能是一种分子和一种离子
8.若aXm+与bYn-的核外电子排布相同,下列关系式正确的是( )
A.b=a-n+m B.b=a-n-m C.离子半径Xm+<Yn+ D.原子半径X<Y
9.硼元素有两种天然同位素105B和115B,已知硼元素的相对原子质量为10.80,则硼元素中105B的质 量分数的下列判断中,正确的是( )
A.20% B.略大于20% C.略小于20% D.80%
10.能证明氯化氢是共价化合物的是( )
A.氯化氢极易溶于水 B.液态氯化氢不导电
C.氯化氢在水中完全电离 D.氯化氢热稳定性高
11、下列各组物质中化学键的类型相同的是( )
A、NH3 H2O CO2 B、H2O Na2O CO2
C、CaCl2 NaOH H2O D、HCl MgCl2 NH4Cl
12.下列属于极性分子的是( )
A、HCl和O2 B、Na2O2和H2O C、HF和H2S D、CO2和CH4
13.下列变化过程中,共价键被破坏的是( )
A、烧碱溶于水 B、氯化氢气体溶于水 C、二氧化碳变成干冰 D、碘溶于酒精
14.超临界流体是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中错误的是()
A、超临界二氧化碳是新合成的一种物质 B、超临界二氧化碳由C02分子构成
C、用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去
D、用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
15.下列结论正确的是 ()
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A. 只有⑥ B. ①③④ C. 只有① D. ②④⑥
16.石榴石是石榴石族矿物的总称,颜色随成分的不同而变化,其组成可以表示为A3B2(SiO4)3,式中A、B均为金属元素,则A、B对应的化合价依次为( )
A. +2,+2 B. +3,+2 C. +2,+3 D. +3,+3
17.自然界中氯化钠是由2311Na与3517Cl和3717Cl所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含3717Cl的质量为( )
A.1.5g B.1.65g C.1.75g D.1.85g
18.某简单离子核内有n个质子,该离子的电子层排布与氖原子相同,则它所带电荷的数值可 能为( )
A.n-10 B.10-n C.n+10 D.n/10
19.已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
A.铍的原子半径大于硼原子半径。 B.氯化铍分子中铍原子的电子数是8。
C.氢氧化铍的碱性比氢氧化钙弱。 D.单质铍与冷水反应产生氢气。
20.短周期元素X和Y,X原子最外层电子数是内层电子数的一半,Y元素在X元素的前一周期, Y2-离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法是:( )
A.可能是一种酸酐 B.Z是一种碱性氧化物
C.Z的分子式可能是X2Y5 D.Z是一种离子晶体
21.元素A的最高正价和负价的绝对值之差为6,B元素和A元素原子的次外层都有8个电子,AB2在水溶液中电离出电子层结构相同的离子,则AB2是( )
A.MgF2 B.CaCl2 C.K2S D.Na2O
![]() 22.A、B、C均为短周期元素,它在周期表中的位置如图所示。B、C两元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是:( )
22.A、B、C均为短周期元素,它在周期表中的位置如图所示。B、C两元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是:( )
A.C、Al、P B.N、Mg、S C.O、P、Cl D.O、Cl、P
23.同主族的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是HXO4<HYO4<HZO4,则下列判断正确的是:( )
A.非金属性强弱为X>Y>Z B.气态氢化物的稳定性由强到弱的顺序为X、Y、Z
C.原子序数大小为X>Y>Z D.阴离子的还原性由强至弱的顺序为X、Y、Z
24. 0.75 mol RO2-3共有30 mol电子,则R在周期表中的位置是:( )
A.第二周期 B.第三周期 C.第ⅣA族 D.第ⅥA族
25.甲烷分子为空间正四面体,碳原子处在正四面体的中心,四个氢原子分别处在正四面体的四个顶点上。因为空间对称,它是一个非极性分子,若用一个氯原子取代一个氢原子后,形成一氯甲烷(CH3Cl),下列对一氯甲烷的说法,正确的是( )
A.正四面体 B.非极性分子 C.极性分子 D.四面体
26.A和B 是短周期中的两种元素, 它们的离子A- 和 B2+ 具有相同的电子层结构, 下列比较中正确的是( )
A、原子半径 A > B B、离子半径 A- > B2+
C、原子中的中子数 A > B D、原子序数A > B
27.已知短周期元素的离子aA2+、bB+、cC3—、dD— 都具有相同的电子层结构,则下列叙述正确的是:( )
A.元素的非金属性:A > B > D> C B.原子序数:d>c>b>a
C.离子半径:C3—> D—> B+> A2+ D.原子半径:B>A>C>D
28.用NA表示阿佛加德罗常数, 下列叙述中正确的是( )
A、18 g 的H2O中含有NA 个质子
B、1/18 mol的1H35Cl分子所含中子数约为6.02×1023
C、3.5 g的35Cl2气体的体积为2.24 L
D、1 mol Fe 作为还原剂提供的电子数一定为 2NA
29.NA代表阿伏加德罗常数,下列说法不正确的是( )
A.16 g18O2中含的原子数为NA
B.在常温常压下,1mol氖气含有原子数为NA
C.1 mol H2O在标准状况下所占体积约为22.4 L
D.1 mol H2O2分解时,电子转移总数为NA
30.下列各微粒的图或式表示正确的是 ( )
A.HClO结构式:H—O—Cl B.MgBr2电子式:Mg2+![]()
C.Al3+离子结构示意图:![]() D.NH3电子式:
D.NH3电子式:![]()
31.下列各组指定原子序数的元素,不能形成AB2型化合物的是( )
A、6和8 B、16和8 C、12和9 D、11和16
32.下列指定粒子的个数比为2∶1的是( )
A.Be2+离子中的质子和电子
B.![]() 原子中的中子和质子
原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)固体中的阴离子和阳离子
33.已知LiH属于离子化合物,LiH与水反应可放出氢气,下列叙述中正确的是( )
A.LiH的水溶液呈酸性 B.LiH是一种强氧化剂
C.LiH中氢离子可被还原为氢气 D.LiH中氢离子与锂离子核外电子排布相同。
二、填空题:
34.有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ________ B __________ C __________ D ___________
(2)写出AB2 的电子式为 ______________
(3)画出D的原子结构简图 ___________________, 用电子式表示化合物 C2D 的形成过程 _____________________________________。
35.据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其极强的爆炸性,又称为“盐粒炸弹”。科学家发现“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形,如果5个N结合后都达到8电子结构,
且含有2个氮氮叁键,则“N5”分子碎片所
带电荷是____________,写出它的电子式:_______________________________________
在1999年曾报道合成和分离了含高能量正离子N的化合物 N5AsF6(N与As是同主族元素) ,
那么“N5”正离子共有 个核外电子,化合物N5AsF6中As化合价为 ,F化合价为 。
36.A、B、C、D四种短周期元素的原子序数依次增大。A、D同主族,B、C同周期。A、B组成 的化合物甲为气态,其中A、B原子数之比为4∶1。由A、C组成的两种化合物乙和丙都为液态 ,乙中A、C原子数之比为1∶1,丙中2∶1。由D、C组成的两种化合物丁和戊都为固态,丁中 D、C原子数之比为1∶1,戊中为2∶1。写出化学式,甲 ,
乙 ,丙 ,丁 ,戊 。
37.某简单微粒的结构示意图为
![]() ,且X、Y 均为不大于20的正整数,据此回
,且X、Y 均为不大于20的正整数,据此回
答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为
(3)若该微粒为阳离子,且对应的碱为可溶性强碱,则x= y= 。
38.有A、B、C、D四种元素,常温下A单质为深红色液体,B、C、D三种元素原子核内质子数均小于18,且三者的单质在一定条件下能相互化合;D元素原子的K层电子数是B元素原子核外电子数的两倍;C、D元素具有相同的最外层电子数,且C元素原子核内质子数是D元素原子核内质子数的一半。
(1)A是 元素、B是 元素、C是 元素、
D是 元素。
(2)用电子式表示B、D两种原子形成化合物的过程
(3)C与D形成的一种化合物,常温下为易挥发的晶体,该化合物的化学式为
参考答案
一、选择题
A2D3B4D5D6A7D8BC9C10B11A 12C
13B14A15D16C17D18AB19AC20AC21B22C23CD24BC
25CD26B27CD28B 29A C30A31D32A33D
二、(本题包括5小题,共36分)
34、(1)碳、氧、钠、硫(2)O::C::O(3)
![]()
![]() Na× + .S . + Na× → Na+[:S:]2-Na+
Na× + .S . + Na× → Na+[:S:]2-Na+
35.(6分)+1 , 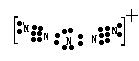 , 34 , +5 , -1
, 34 , +5 , -1
36答:CH4 H2O2 H2O Na2O2 Na2O
37.(1)Ar (2) ![]() (3)x=19 y=8
(3)x=19 y=8
38. (1)A—溴 B—氢 C—氧 D—硫
(2)H×+· ![]() ·+×H
·+×H![]() H
H![]()
![]()
![]() H
H
(3)SO3