高一化学第二学期中考试卷
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Al-27 Si-28 S-32
K-39 Cu-64 Ba-137
第I卷(共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
A.18O 31P 119Sn B.27Al 19F 12C
C.元素周期表中第1周期所有元素的原子 D.元素周期表中VA族所有元素的原子
 2.如图是1989年世界环境日主题宣传画《啊!地球出汗了》,这幅宣传画所揭示的全球主要环境问题是
2.如图是1989年世界环境日主题宣传画《啊!地球出汗了》,这幅宣传画所揭示的全球主要环境问题是
A.酸雨 B.臭氧空洞
C.温室效应 D.光化学烟雾
3.下列互为同位素的是
A.H2和D2
B.![]() H和
H和![]() H
H
C.H2O和T2O D.O2和O3
4.下列物质能使品红褪色,但漂白原理与众不同的是
A.NaClO B.等物质的量的Cl2和SO2 C.SO2 D.O3
5.下列关于氧族元素的说法中,正确的是
A.硫是一种比较活泼的非金属,反应中只能充当氧化剂
B.氢化物、最高价氧化物水化物的水溶液酸性变化一致
C.单质的沸点、密度的变化一致
D.硫、氧与Fe反应产物中Fe的价态是一致的
6.下列说法不正确的有
A.硅酸盐工业使用的每一种原料中都必须含有硅
B.水泥、普通玻璃都是混合物
C.生产水泥、玻璃都需用石灰石
D.纯净的石英可制成石英玻璃,因膨胀系数小,常用来制造耐高温的化学仪器
7.“浓硫酸可用铁罐贮存,但其外表常有严重的腐蚀现象”这句话体现了浓硫酸的
A.强氧化性和脱水性 B.强氧化性、吸水性和酸性
C.不挥发性和酸性 D.脱水性和吸水性
8.下列结论正确的是
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Te
③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H3PO4 ⑥非金属性:F>Cl>S>Si
A.②④⑥ B.①③④ C.只有① D.只有⑥
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
9.某硅酸盐样品含镁质量分数为40%,其化学组成表示为nMgO·SiO2,则n的值等于
A.2
B.3 C.4 D.![]()
10.对于反应Br2+SO2+2H2O==2HBr+H2SO4和2HBr+H2SO4(浓)==Br2+SO2↑+2H2O,下列说法正确的是
A.它们互为可逆反应
B.反应条件的改变引起了反应方向的改变,它们都符合事实
C.它们互相矛盾,不可能符合事实
D.氧化性:浓H2SO4>Br2>稀H2SO4
11.下列有关阿佛加德罗常数(NA)的说法正确的有
A.标准状况下,11.2L SO3所含的原子数目为2NA
B.16gO2和O3的混合物中,氧原子数一定为 NA
C.0.1mol/L的100mL H2SO3溶液中,含有的离子数远小于0.03 NA
D.0.6g C与10.0g 98%的H2SO4反应可得0.1NA个SO2气体分子
12.下列离子方程式不正确的是:
A.H2S气体通入足量的NaOH溶液中: H2S+OH—=HS—+2H2O
B.过量的CO2通入澄清石灰水:CO2+OH—=HCO3—
C.Al2O3与盐酸的反应:Al2O3+6H+=2Al3++3H2O
D.碳酸钡中滴加稀硫酸:BaCO3+2H+ = Ba2++CO2↑+H2O
13.甲、乙、丙三种不同浓度的稀H2SO4,分别跟等物质的量的Al、KHCO3和CuO刚好反应完全,所耗去甲、乙、丙三种酸的体积比为1∶2∶3,则甲、乙、丙三种酸物质的量浓度之比应是
A.1∶1∶1 B.3∶1∶2 C.6∶3∶2 D.18∶3∶4
14.吸进人体内的O2有约2%转化为氧化性极强的活性氧副产物(如O2—),这些活性氧能加速人体衰老,被称为“夺命杀手”。人们尝试:①用含硒化合物Na2SeO3消除人体内活性氧;②在护肤品中加入SOD(超氧化物歧化酶),促使O2—等转化为双氧水、氧气等,从而消除体内活性氧。在消除活性氧时,下列说法不正确的是:
A.方法②护肤品中加入的SOD是消除体内活性氧的催化剂
B.方法②的反应可表示为:2O2— + 2H2O![]() H2O2
+ O2 + 2OH—
H2O2
+ O2 + 2OH—
C.方法①可取,因为Na2SeO3可做还原剂,且硒又是人体内一种必需微量元素
D.方法①不可取,因为Na2SeO3不可做还原剂,且硒对人体有害。
15.下面各表都表示周期表的一部分,表中的数字表示原子序数,表中数字所表示的元素与它们在周期表中位置关系相符的一组是
A. B.
| 1 | 2 | |
| 11 | ||
| 19 |
| 4 | 5 | 6 |
| 12 | 13 |
C. D.
| 4 | ||
| 10 | 11 | 12 |
| 20 | ||
| 2 | ||
| 8 | ||
| 16 | 17 | 18 |
16.二氧化硅晶体是立体的网状结构,其晶体
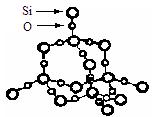 结构如右图。关于二氧化硅晶体的下列说
结构如右图。关于二氧化硅晶体的下列说
法中不正确的是
A.晶体中Si、O原子个数比为1:2
B.晶体中最小环上的原子数为8
C.晶体中一个硅原子共用的最小环的数目为4
D.晶体中Si、O原子最外层都满足8电子结构
17.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
O3→H2O+O2;MnO4-→Mn2+;Cl2→2Cl-;H2O2→H2O。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.O3 B.MnO4- C.Cl2 D.H2O2
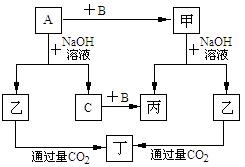 18.由短周期元素组成非金属单质A、B、C和甲、
18.由短周期元素组成非金属单质A、B、C和甲、
乙、丙、丁四种化合物有如图所示转化关系,
且已知C为密度最小的气体。
A.单质A既可能是Al也可能是Si
B.A与NaOH溶液的反应既体现出元素A的
金属性也体现出元素A的非金属性
C.乙→丁的离子反应方程式为:SiO32-+CO2
+H2O=CO32-+H2SiO3↓
D.化合物甲的重要用途之一用作高性能通信材料
第II卷(共78分)
三.(本题包括2小题)
19.甲乙两学生分别对SnCl4,PbCl4,GeCl4,AlCl3进行研究,甲认为:这些都是非金属性很强的氯跟金属元素形成的盐,所以都是离子化合物;乙认为:这些都是金属性并不是太强的金属形成的氯化物,是共价化合物。你如何用实验解决二人的争执?
。
20.某课外实验小组同学进行气体的制取和性质验证的研究。他们设计了一套实验装置(如下图),用该装置能够进行多种气体的制取和性质验证实验(进行不同气体的制取和性质验证实验时,可以根据需要增减、调换部分装置)。
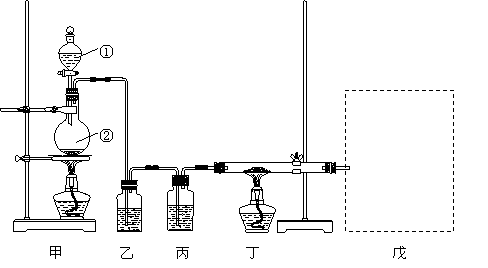
请根据上图回答问题:
⑴写出上图装置中有标号的仪器名称:①_____________②_____________;
⑵王林同学查到草酸(H2C2O4)晶体和浓H2SO4混合加热可以生成CO和CO2。
H2C2O4
![]() CO+CO2+H2O
CO+CO2+H2O
根据此反应,用上图装置制取纯净、干燥的CO,并用CO还原Fe2O3。则乙中盛有NaOH溶液,其作用是_________________________;丙中应盛放的试剂是_____________;戊中的装置应选用下图中的_______________装置(填序号) 更合理。
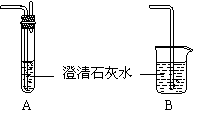
⑶李明同学设计用Na2SO3固体跟盐酸加热反应制取纯净的SO2,探究过氧化钠与二氧化硫的反应事实。
①此时乙中盛有的是饱和Na2SO3溶液,其作用是_______________________;丙中盛装的试剂为 。
②实验中在对尾气成分的检验中发现有能使带余烬的木条复燃的气体产生,则戊装置选择上图中的 装置(填序号)更合理,盛装试剂应改为 。
③在对反应后丁装置中固体盛成分的分析中,李明推测可能有Na2SO4生成并设计了如下实验予以证明。
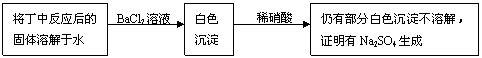 |
上述方案是否合理? 。请简要说明两点理由:
(Ⅰ) ;
(Ⅱ) 。
四.(本题包括2小题)
21.氮化硅是一种新型无机非金属耐高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍用高纯硅与纯氮在1300℃时反应获得。
⑴根据性质推测氮化硅陶瓷的用途是_________(填序号)。
A.制汽轮机叶片 B.制有色玻璃 C.制永久性模具 D.制柴油发动机
⑵写出氮的原子结示意图:______________,根据元素周期律知识,请写出氮化硅的化学式:______________________;
⑶氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其它无机酸反应,试推测该氮化硅陶瓷被氢氟酸腐蚀的化学方程式_________________________________;
⑷现用四氯化硅和氮气、氢气在强热有条件下发生反应,可得较高纯度的氮化硅,反应的化学方程式_________________________________________。
22.20世纪中叶以来,工业的迅猛发展使得人类生存的环境变得越发恶劣。保护环境就是保护自己。
⑴粉笔是现阶段必备得教学用品,也是教室内空气的主要污染源,粉笔的生产过程可
简示如下:
 |
试回答:第一步反应的有关方程式 ;目前我校广泛使用的是“绿叶牌”无尘粉笔,无尘粉笔的生产是在A中加入了少量的甘油和纯碱。其中甘油具有很强的吸湿性,防止形成粉尘,而纯碱则是为了增加硬度,其有关的反应方程式为 。
⑵实验室中也常因一些有毒气体的排放而污染空气。例如用Cu与浓H2SO4直接反应制备硫酸铜同时会带来SO2污染。工业上不是用Cu与浓H2SO4在加热条件下反应,而是将铜丝浸入稀硫酸中,再不断向容器中鼓入空气而制得CuSO4,试写出相关反应离子方程式 。
五.(本题包括2小题)
23.许多元素都存在同位素,同位素在日常生活、工农业生产和科学研究等方面具有很重要的用途,如临床治癌、研究反应机理、核动力发电等。
⑴国际上一致以碳元素的一种同位素原子—— 原子质量的![]() 作为标准来衡量各种原子的相对原子质量。
作为标准来衡量各种原子的相对原子质量。
⑵据报道,上海某医院正在研究用放射性同位素![]() 治疗肿瘤。该同位素原子核内的中子数是
,该原子的质量是上述碳原子质量的
倍。
治疗肿瘤。该同位素原子核内的中子数是
,该原子的质量是上述碳原子质量的
倍。
⑶硼元素只有两种天然同位素![]() 和
和![]() ,硼元素的近似相对原子质量为10.8,则天然硼元素中
,硼元素的近似相对原子质量为10.8,则天然硼元素中![]() 的质量分数为
。
的质量分数为
。
⑷有机化学中常用18O原子作示踪原子来研究乙酸(![]() )与乙醇
)与乙醇
(CH3-CH2-O-H)反应生成酯(![]() )和水的反应机理,反应过程中乙酸分子断裂C—O单键,醇分子断裂O—H键。试完成下列反应方程式:
)和水的反应机理,反应过程中乙酸分子断裂C—O单键,醇分子断裂O—H键。试完成下列反应方程式:
![]() +
+![]()
![]() 。
。
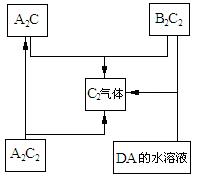 24.有原子序数均小于20的A、B、C、D四种元素,已知A和B在同一主族,B的阳离子与C的阴离子核外电子层结构相同;其中四种元素形成部分单质及其化合物之间有如下关系(反应中部分产物被省略):
24.有原子序数均小于20的A、B、C、D四种元素,已知A和B在同一主族,B的阳离子与C的阴离子核外电子层结构相同;其中四种元素形成部分单质及其化合物之间有如下关系(反应中部分产物被省略):
试回答下列问题:
⑴化学物B2C2所含化学键的类型包括
。
⑵元素C在周期表中位置:_______周期_______族。
⑶用电子式表示出化合物DA的形成过程
。
⑷写出化合物A2C2的任一用途 。
五.(本题包括2小题)
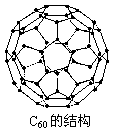 25.目前,化学家们已经找到十余种富勒烯(Cx),它们的分子结
25.目前,化学家们已经找到十余种富勒烯(Cx),它们的分子结
构都是只由正五边形和正六边形构成的封闭的凸多边形,且顶
点数、面数和棱边数有如下关系:顶点+面数-棱边数=2。
C60就是其中的一种。试分析下列物质中不属于富勒烯家族的有
。
A.C18 B.C44 C.C72 D.C83
26.现有某浓硫酸20.0 mL,加入铜屑共热一段时间后,冷却,滤去多余的铜屑,将滤液加水稀释至100.0mL,分成2等份,其中一份加入足量2mol/LBaCl2溶液,将所得沉淀干燥称量质量为37.28g;另一份逐滴加入NaOH至沉淀最大量时过滤、干燥、灼烧、称量得1.92g黑色固体。试求该20mL溶液中H2SO4的物质的量浓度。