高一化学第二章检测题
第I卷(选择题,共60分)
选择题(每小题有一个或两个选项符合题意。每小题3分,共60分。)
1.做焰色反应实验用的铂丝,每实验一种样品后都必须 ( )
A.用水洗涤2—3次后再使用
B.用滤纸擦干净后,才可使用
C.用盐酸洗涤后,经蒸馏水洗涤,才可使用
D.用盐酸洗涤后,在灯焰上灼烧,到不产生焰色后才可使用
2.关于锂、钠、钾、铷、铯的性质递变规律,不正确的叙述是 ( )
A.单质的密度依次增大
B.单质的熔、沸点依次降低
C.单质还原性依次增强
D.离子的氧化性依次减弱
3.加热NH4HC03固体,使产生的气体依次通过盛有过量Na202的干燥管、浓H2S04的洗气瓶,最后得到的气体是 ( )
A.02 B.NH3 C.C02 D.C02和02
4.将等质量的Na、K、Zn分别投入到含等量HCl的稀盐酸中,产生H:量的多少不会出现下列情况中的( )
A.Zn>Na>K B.Na>K>Zn
C.Na>Zn>K D.Na>K=Zn
5.以下关于铷的叙述,不正确的是 ( )
①铷的密度比钠大,熔点比钠高;
②与冷水不反应,与热水反应放出氢气;
③铷盐大多数都易溶于水;
④铷的原子半径和离子半径都分别比钠大。
A.①② B.②③ C.③④ D.①④
6.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,根据碱金属性质预测其性质,其中不正确的是( )
A.在碱金属元素中它具有最大的原子半径
B.钫在空气中燃烧时,只生成分子式为Fr20的氧化物
C.它的氢氧化物分子式为FrOH,这是一种极强的碱
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
7.将C02通人CaCl2溶液中,未见沉淀生成,再加入下列
试剂后即有白色沉淀产生 ( )
A.热水 B.苛性钠溶液
C.氨水 D.氯化钠溶液
8.甲、乙、丙、丁各是Na2C03、AgN03、HCl、BaCl2四种溶液中的一种,它们两两反应后的现象如下:甲+乙→白色沉淀;甲+丙→白色沉淀;乙+丙→白色沉淀;丙+丁→白色沉淀;乙+丁→五色无味气体;则甲、乙、丙、丁依次是 ( )
A.Na2C03、HCl、AgN03、BaCl2
B.BaCl2、Na2C03、HCl、AgN03
C.AgN03、HCl、BaCl2、Na2C03
D.BaCl2、Na2C03、AgN03、HCl
9.为除去括号内的杂质,所选用的试剂或方法不正确的是 ( )
A.Na2C03溶液(NaHC03),选用适量的NaOH溶液
B.NaHC03溶液(Na2C03),应通人过量的C02气体
C.Na2O2 粉末(Na20),将混合物在空气中加热
D.Na2C03溶液(Na2S04),加入适量的Ba(OH)2溶液,过滤
10.有两个无标签的试剂瓶,分别装有Na2C03和NaHCO3 ,有四位同学为鉴别它们,采用了以下不同方法,其中可行的是 ( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再加入NaOH溶液
C.分别将它们配制成溶液,再进行焰色反应
D.分别加热,再用石灰水检验是否有气体产生
11.等质量的Na2C03和NaHC03固体分别与足量的10%的盐酸反应,下列叙述中正确的是 ( )
A.NaHC03产生的气体较多
B.Na2C03产生气体的速率较快;
C.Na2C03产生的气体较多
D.NaHC03消耗盐酸的质量较少
12.下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是 ( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
13.1.56g某碱金属与足量盐酸反应,得到标准状况下的氢气448mL [ρ(H2)=0.0893g/L],该金属的相对原
子质量为 ( )
A.85 B.24 C.39 D.7
14.有四种含钠的化合物W、X、Y、Z,根据下列变化推断与W、X、Y、Z的分子式对应的一组是 ( )
W→X+C02↑+H20 Z+C02→X+02↑
Z十H20→Y十02↑
X+Ca(OH)2→Y+CaC03↓
A.Na2C03、NaHC03、NaOH、Na202
B.NaOH、Na202、Na2C03、NaHC03
C.NaHC03、NaC03、NaOH、Na202
D. NaHC03、Na2C03、Na202、NaOH
15.下列六种物质:①Na20 ②Na202 ③NaCl ④Na2C03溶液⑤NaOH ⑥NaHC03中,不能与二氧化碳反应的是 ( )
A.①④ B.②③ C.③⑥ D.⑤⑥
16.有水参加的氧化还原反应:①Na+H20②Na2O+H20,③Na202+H20,④C12+H20,⑤S02+H20,其中水既不是氧化剂又不是还原剂的是 ( )
A.①③ B.②⑤ C③④ D.④
17.下列离子方程式正确的是 ( )
A.小块钠投入硫酸铜溶液中:
2Na+Cu2+=Cu+2Na+
B.在碳酸氢钠溶液中加入足量石灰水:
HCO3-+Ca2++OH-=CaC03 ↓+H20
C.钠与水反应:Na+2H20=Na++20H-+H2↑
D.向氢氧化钠溶液中通人足量C02:C02+OH-=HCO3-
18,下列各组物质作用时,反应条件改变,不会引起产物种类改变 ( )
A.Na和02
B.NaOH溶液和CO2
C.Na202和C02
D.NaOH溶液和Ca(HCO3)2 溶液
19.把一瓶NaOH溶液分成二等份,一份密封保存,另一份敞口放置,几天后用组成相同的盐酸去中和它们至溶质均为NaCl。若第一份用去盐酸V1mL,第二份用去盐酸V2mL,则Vl和V:的关系是 ( )
A.V1:V2 B.V1>V2
C.V1<V2 D.V1≤V2
20.在一定温度下,向某饱和硫酸钠溶液中加入a g无水Na2S04粉末,搅拌、静置后,析出bg Na2S04·10H20晶体。下列量中,可以根据已知条件计算的 ( )
①该温度下硫酸钠的溶解度
②原饱和溶液减少的水的质量
③原饱和溶液减少的溶质的质量
④析出晶体中含Na2SO4的质量
21.(5分)实验室因保存不慎会使烧碱溶液变质,这是因为了检验一瓶烧碱溶液是否变质,应向试样溶液中加入______________,若______________的现象,说明烧碱溶液已变质。为了除去变质烧碱溶液中
所含的杂质而将烧碱溶液提纯,应加入的试剂是______________其主要实验操作是______________
22.(12分)某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。
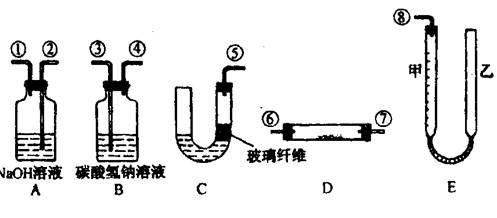
图中量气装置E是由甲乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。试回答:
(1)图中装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略)
(2)装置C中放入的反应物是______________和_______________
(3)装置A的作用是______________;装置B的作用是
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意______________和______________(填写字母编号)。
a.视线与凹液面最低处相平。
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
23.(18分)某银白色金属固体A:
①放在空气中氧化成白色固体B;
②将A点燃火焰呈黄色,生成浅黄色固体C;
③A、B、C均可跟五色液体D反应,生成碱性物质E,其中A跟D反应时还可生成可燃性气体F,C跟D反应时则生成另一种气体C;④F和G混合遇火可
剧烈反应而发生爆炸,并生成D。据此推断:
(1)A为__________,B为__________,
C为__________,D为__________,
E为__________,F为__________, G为__________。
(2)写出下列反应的化学方程式:
①A→B______________________________,
②A→E______________________________,
③C→E_______________________________。
24.(15分)工业制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面方度式表示:
NH3+C02+H20=NH4HC03
NH4HC03+NaCl(饱和)=NaHC03↓+NH4Cl
以上反应总结果是放热反应。请设计一个实验,用最简单的实验装置模拟实现这一过程,获得NaHC03结晶。可供选择的实验用品有:20%的盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水、冰,以及中学化学常用仪器。
 |
(1)画出实验装置示意图(包括反应时容器中的物质),并在图中玻璃容器旁自左至右分别用A、B、C、…符号标明。所有仪器的简要画法请见下面的两点说明。
①
②铁架台、石棉网、酒精灯、玻璃导管之间的联接等,在示意图中不必画出。如需加热,可在需加热的仪器下方标出“△”表示。
(2)写出上图中用A,B,C,…各玻璃容器中盛放的物质的化学式或名称。
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶。
25.(10分)一定质量的小苏打粉末经充分加热后,质量比原来减少了3.1g,剩余物的质量为Ag;相同质量的小苏打和一定质量的结晶苏打(Na2C03·xH20)的混合物,经充分加热后,质量比原来减少了10.3g,剩余物的质量为Bg;又知B:A=2:1。试求:
(1)原小苏打和结晶苏打的质量;
(2)结晶苏打化学式中x的值。
26.在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9kg氧气,呼出1.Okg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。有的科学家提出“金属过氧化物处理系统”即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①__________②__________;将处理后的气体充入座舱时,应注意采取的一项措施是______________________________。
第二章 检测题答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | A | A | A | A | B | BC | D | D | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| AD | B | C | C | C | C | BD | C | A | D |
21吸收空气中的CO2生成Na2CO3的缘故;取少量试液,加入BaCl2 ;有沉淀生成;适量的石灰水;滴加石灰至不再产生沉淀为止,经过滤即可。
22
(1)⑤、③、④、⑥、⑦、②、①、⑧(⑥、⑦可对换)。
(2)大理石;盐酸。
(3)除去混在O2 中未反应的CO2;吸收C02中混有的HCl.
(4)a;c。
23(1)A.Na;B.Na2O ;C. Na2O2 ;D.H20;E.NaOH;F.H2;G.02
(2)①A→B:4Na+02=2Na2O ②A→E:2Na+2H20=2NaOH+H2↑③C+E:2Na202+2H20=4NaOH+02↑24.(1)见下图。
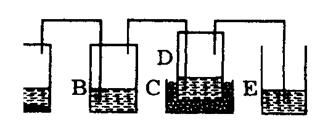
(2)A:CaC03,并由漏斗加入 6mol/L HCl;B:蒸馏水;C:冰水;D:氨化的饱和NaCl 溶液;E:6moL/LH2S04 (3)取少量产品放在试管中,在酒精灯上加热至不再有气体放出时,停止加热。试管中如有白色剩余物质,则得到的产品不是碳酸氢铵。试管冷却后,向其中加入适量盐酸,反应激烈,冒大量气泡,最后剩余物全部溶解,说明得到的结晶是碳酸氢钠;如果加入盐酸后,晶体全部溶解,但没有气泡产生,则得到的结晶可能是食盐。
25 (1)8.4g 12.5g (2)8
26 2CO2+2Na2O2=2Na2CO3 +O2↑
2H2O +2Na2O2 =4NaOH+O2 ↑
补充适量的水蒸气