高一化学第二学期复习题
(完成时间90分钟 满分100分)
可能用到的相对原子质量:
H-1、 C-12.、 N-14、 O-16、 Na-23、 Al-27、 S-32、C1-35.5、K-39
第1卷(选择题共 50分)
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。)
1.下列气体直接排放到空气中不会造成污染的是
A.CO2 B.SO2
C.O3 D.CO
2.常温常压下,属于有毒有色的气体是
A.CO B.SO2
C.Cl2 D. Br2
3.阴阳离子的电子层结构都与Ar原子相同的离子化合物是
A.MgBr2 B.CaF2
C.K2S D.NaCl
4.某二价阳离子含24个电子,它的质量数为56,则该离子核内中子数是
A.24 B.30 C.32 D.34
5.某元素原子的最外层电子数与次外层电子数相同,且最外层电子数与次外层电子数之和小于 8 ,该元素为
A.锂 B.铍 C.氦 D.钙
6.在某溶液中滴加用盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中
A.一定含有Ag+ B.一定含有Ag+和SO42-
C.一定含有SO42- D.含有Ag+或SO42-
7.黑火药爆炸时发生如下反应:2KNO3+3C+S=K2S+N2 +3CO2 ,该反应中作氧化剂的物质是
A.KNO3 B.C、S
C.KNO3、S D.N2、CO2
8.下列各元素的氧化物中, 既能与盐酸反应, 又能够与 NaOH 溶液反应的是
A.元素X: 它的原子中 M 层比L 层少 2 个电子
B.元素Y: 地壳中含量居第二
C.元素Z: 位于元素周期表中的第三周期, ⅢA 族
D.元素W: 它质子数比焰色反应颜色呈紫色的元素少13
9.关于氧族元素性质的叙述正确的是
A.随核电荷数的增加,氧、硫、硒、碲元素的非金属性逐渐增强
B.H2SO4的酸性比H2TeO4强
C.H2S的稳定性比H2Se弱
D.在OF2化合物中氟元素是+1价,氧元素是-2价
10.下列关于物质性质变化的比较, 不正确的是
A.还原性强弱: F- > Cl- > I-
B. 原子半径大小: Se> S > O
C.碱性强弱: NaOH > Mg(OH )2> Al(OH)3
D. 酸性强弱: HI > HBr > HCl > HF
11.某元素原子的最外层只有2个电子,则该元素
A.一定是ⅡA族元素
B.—定是金属元素
C.一定是正二价元素
D.可能是金属元素,也可能不是金属元素
12.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑(NaBH4中H元素为-1价),对于此反应,下列说法中正确的是
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为2 :1
13.在5L硫酸铝溶液中含硫元素的质量为48g,则此溶液中Al3+离子的物质的量浓度为
A.0.2 mol·L-1 B.0.3mol·L-1
C.1.5mol·L-1 D. 0.67mol·L-1
14.下列元素中最容易形成阳离子的是
A.Na B.Br C.F D.K
15.比原子序数为11的元素原子少一个电子而又多一个质子的微粒是
A.Na+ B.Na C.Mg2+ D.Mg
16.下列离子化合物中,阳离子半径与阴离子半径之比最小的是
A.NaF B.LiI C.CsF D.LiF
17.下列分子中,同时含有离子键和非极性键的是
A.CO2 B.H2O C.Br2 D.Na2O2
18.下列说法正确的是
A.二氧化硅溶于水显酸性
B.二氧化碳通入硅酸钠溶液中可以得到硅酸
C.二氧化硅是酸性氧化物,它不溶于任何酸
D.因为高温时SiO2可和Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
19.A、B、C、D、E 是短周期中同一周期的五种元素, A和B的最高价氧化物对应的水化物呈碱性, 且碱性前者强于后者, C和D的最高价氧化物的水化物呈酸性, 且酸性前者强于后者, 五种元素形成的简单离子中,E的离子半径最小, 则它们的原子序数由大到小的顺序是
A. CDEBA B. ECDAB
C. BAEDC D. BADCE
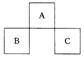 20. A、B、C均为短周期元素,它们在周期表中的位置如图所示。
20. A、B、C均为短周期元素,它们在周期表中的位置如图所示。
已知:B、C两元素原子最外层电子数之和等于A元素原子最
外层电子数的2倍;B、C两元素的核电荷数之和是A元素原
子序数的4倍。则A、B、C分别是
A.C、Al、P B.N、Si、S
C.O、P、Cl D.F、S、Ar
21.O2、SO2、SO3三者的质量比为2 :4 :5时,它们的物质的量之比为
A.2 :4 :5 B.1 :2 :3
C.1 :1 :1 D.2 :2 :3
22.下列离子方程式正确的是:
A.H2SO4和Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4 +H2O
B.铁丝放入盐酸中:2Fe+6H+=2Fe3++3H2
C.亚硫酸(H2SO3)与氢氧化钠溶液混合:H++OH-=H2O
D.CO2通入足量的烧碱溶液中:CO2+2OH-=CO32-+H2O
23.以下变化体现硫酸强氧化性的是
A.用硫酸和锌粒反应制氢气
B.硫酸溶解红色铁锈
C.硫酸干燥氢气
D.硫酸作用于蔗糖产生黑色泡沫
24.设NA表示阿伏加德罗常数,下列说法正确的是
A.7.1g Cl2发生还原反应时得到的电子数目为0.1NA
B.标况下22.4L水中所含的电子数目为NA
C.NA个氮分子和NA个氢分子的质量比为14 :1
D.NA个Na原子的质量是1g
25.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)
A.![]() L B.
L B.![]() L C.
L C.![]() L D.
L D.![]() L
L
高一化学模拟考试答题卷
| 题号 | 一 | 二 | 三 | 四 |
| 得分 |
|
|
|
|
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。请将答案填入下表!)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(共17分)
26(13分).下表是元素周期表的一部分,针对表中的(1)-(10)元素,用元素符号、名
称或化学式填空:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | (1) | (2) | (3) | |||||
| 3 | (4) | (5) | (6) | (7) | (8) | |||
| 4 | (9) | (10) |
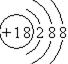
A.在这些元素中,化学性质最不活泼的是 , 此元素的原子结构示意图为 ;
B.金属铜与(6)元素的最高价氧化物的水化物反应的化学方程式:
;
C.在非金属元素的最高价氧化物对应的水化物中酸性最强的是 ,在金属元
素氧化物对应的水化物中,碱性最强的是 ;具有两性的化合物是 。
D.地壳中含量最多的元素是 ,空气中含量最多元素是 ,常温下呈
液态的非金属是 。
E.元素(3)的氢化物与元素(7)的单质反应的离子方程式是 。
F.元素(4)最高价氧化物的水化物与元素(5)的最高价氧化物相应的水化物反应的离子方程式 。
27(4分).某溶液中有 K+、Al3+、NO3-、SO42- 等四种离子,已知其中K+、Al3+、NO3-的个数比为2 :3 :9,若已知K+的个数为n,则SO42- 的个数为 。
三、综合推断题(共13分)
28(13分)、有A、B、C三种短周期元素, 它们的原子序数由A到C依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在B的单质Z中加热充分反应, 可以得到淡黄色固态化合物, 试根据以上叙述回答:
(1) 元素名称: A ________ B __________ C __________
(2) 写出AB2 的电子式为 ______________
(3) 画出C的原子结构简图 ___________________, 用电子式表示化合物 C2B 的形成过程 _____________________________________.
(4) B与A、B与C都分别可以形成两种化合物。其中可以使品红溶液褪色的是 (填化学式);这四种化合物之间,室温下可发生氧化还原反应的化学方程式:
。
四、综合实验题(共20分)
29.(9分)为除去下列物质中含有的少量杂质(括号内物质),请按要求填空:
| 物质 | 加入试剂 | 化学方程式或离子方程式 |
| NaCl(NaHCO3) | ||
| Na2SO4(Na2S) | ||
| MgO(Al2O3) |
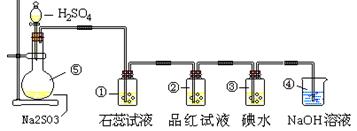 |
30(11分).下图是实验室制取SO2并验证SO2某些性质的装置图。
试回答:
⑴.①中的实验现象为: ,此实验证明SO2是 氧化物;
⑵.②中的品红试液将 ,证明SO2有 性;
⑶.③中的实验现象为 ,发生反应的化学方程式是:
;证明SO2有 性;
⑷.④的作用是 。
(5)⑤中发生反应的化学方程式是 。
参考答案
第1卷(选择题共 50分)
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | C | C | B | B | D | C | C | B | A | D | B |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| A | D | C | B | D | B | A | C | C | D | D | C | A |
二、填空题(共17分)
26(化学方程式每空2分,其余每空1分,共11分) A. Ar , ;
B. Cu + H2SO4 ![]() CuSO4 + SO2 ↑+ 2H2SO4
CuSO4 + SO2 ↑+ 2H2SO4
C.HClO4 , KOH D. O, N, Br
E. Cl2+ H2O = H+ + Cl- + HClO F. Al(OH)3 + OH- = AlO2- +2H2O
27(4分) 0.5n
三、综合推断题(共13分)
28(13分).(1)碳、氧、钠。(各1分,共3分) (2)![]() (2分)
(2分)
(3) (各2分,共4分)
(4) Na2O2; 2Na2O2 + 2CO2 = 2Na2CO3 + O2 (各2分,共4分)
四、综合实验题(共20分)
29(试剂每空1分、方程式每空2分,共9分)
| 盐酸 | H+ + HCO3 - = CO2↑ + H20 |
| 稀硫酸 | 2H+ + S2- = H2S ↑ |
| 氢氧化钠溶液 | Al2O3 + 2OH- = 2AlO2- +H2O |
30(化学方程式每空2分,其余每空1分,共11分)
. (1)石蕊试液变红 酸性 (2)褪色 漂白
(3)碘水变无色 SO2 + H2O + I2 = H2SO4 + 2HI 还原性
(4)吸收过量的二氧化硫,以免污染空气。
(5)Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H20