高一化学第二学期期末调研测试
说明:1、请考生将第Ⅰ卷的答案填在第Ⅱ卷卷首的表格内。
2、考试时间共90分钟,满分100分。
可能用到的元素相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cu 64
第 Ⅰ 卷(50分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。)
1、我国“神舟5号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出,该高温气体成分有CO2、H2O、N2、NO等,这些气体均为无色,但在卫星发射现场看到火箭尾部喷射出大量红色物质,产生的原因是
A 高温下N2遇空气生成NO2 B NO遇空气生成NO2
C CO2与NO反应生成NO2 D NO与H2O反应生成NO2
2、科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发
电过程中具有重要的作用。下列关于硅的说法中错误的是
A 自然界硅的贮量丰富 B 自然界中存在大量单质硅
C 高纯度的硅被广泛用于制作计算机芯片 D 光导纤维的主要成分是二氧化硅
3、为减少酸雨的产生可采取的措施有①少用煤作燃料②把工厂烟囱造高③燃料脱硫
④在已酸化的土壤中加生石灰⑤开发新能源,其中合理的是
A ①②③ B ②③④⑤ C ①③⑤ D ①③④⑤
4、下列分子的电子式书写正确的是
A 氨 ![]() B 四氯化碳
B 四氯化碳 ![]()
C 氮 ![]() D 二氧化碳
D 二氧化碳 ![]()
5、下列物质属于纯净物的是
①水玻璃②水泥③玻璃 ④漂白粉 ⑤胆矾 ⑥氯水⑦ 液氯
A ①④ B ①⑤ C ①⑤⑥ D ⑤⑦
6、我国“嫦娥工程”探月计划的一个重要目标是开发月球新能源——“氦—3”,10吨氦—3就能满足我国一年所有的能源需求。关于氦的该种同位素应表示为
A ![]() B
B ![]() C
C ![]() D
D ![]()
7、下列叙述正确的是
A 同主族元素自上而下,金属性减弱 B 同主族元素自上而下,得电子能力增强
C 同周期元素中,ⅠA族元素的原子半径最小
D 同周期元素中,ⅦA族元素的气态氢化物最稳定
8、下列保存试剂的方法中,错误的是
A 浓硝酸能保存在带磨口玻璃塞的棕色细口瓶中
B 少量白磷通常保存在冷水中
C 水玻璃保存在带橡皮塞的无色细口瓶中
D 硝酸银固体保存在无色的带磨口玻璃塞的细口瓶中
9、下列反应属于氮的固定作用的是
A 闪电中N2和O2反应生成NO B NH3催化氧化生成NO
C NO与O2反应生成NO2 D 由NH3制碳铵和硫铵
10、下列关于浓硫酸和浓硝酸的叙述正确的是
A 常温下都能用铝容器贮存 B 露置在空气中,容器内酸液的质量都减轻
C常温下都能与铁较快反应 D 都有挥发性
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
11、13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
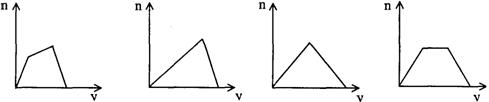 |
12、将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
A B C D
13、有甲、乙、丙、丁四种短周期主族元素,甲、乙同主族,丙、丁同周期,已知甲的阳离子和丁的阴离子的电子层结构相同,丙的阴离子还原性比丁的阴离子还原性弱,则甲乙丙丁原子序数由大到小的顺序是:
A 乙丁丙甲 B 乙甲丙丁 C 甲丙丁乙 D 丙丁乙甲
14、下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是
A Ba2+、Na+、I-、NO3- B Ca2+、Fe2+、NO3-、Cl-
C Na+、K+、S2-、SO32- D K+、Na+、CO32-、SO42-
15、同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是
①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,
试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
16、N0为阿伏加德罗常数的值,下列叙述正确的是
A 80g硝酸铵含有氮原子数为2N0
B 1L 1mol·L-1的盐酸溶液中,所含氯离子数为N0
C 标准状况下,11.2LSO3所含分子数为0.5 N0
D 在铁与硫的反应中,1mol铁失去的电子数为3 N0
17、用98%浓H2SO4吸收SO3可以得到焦硫酸(H2SO4·SO3),若用1kg 98%H2SO4充分吸收SO3得到焦硫酸,再进行稀释,可得到98%的H2SO4的质量为
A.1.98kg B.2.00kg C. 2.22kg D.2.42kg
18、下面是实验室制取氨气的装置和选用的试剂,其中错误的是
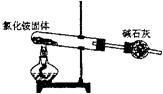


A B C D
|
2KClO3+H2C2O4+H2SO4==2ClO2↑+2K2SO4+2CO2↑+2H2O。下列说法正确的是
A、KClO3在反应中得到电子 B、ClO2是氧化产物
C、H2C2O4在反应中被还原 D、1molKClO3参加反应有2mol电子转移
20、一定质量的Fe和Cu的混合物,先与适量的稀硝酸反应后,剩余a克固体;再向其中加入少量稀硫酸,充分反应后,还剩余固体b克固体。则下列说法正确的是
A、a一定等于b B、a可能等于b
C、a一定大于b D、a一定大于或等于b
高一化学第二学期期末调研测试
第I卷选择题答案纸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷(非选择题,共50分)
三、(本题包括2小题,共11分)
21、(2分)下列说法合理的是
A 在某试样中加入盐酸酸化的氯化钡溶液有白色沉淀生成,可推知试样中肯定存在SO42-。
B 等体积的SO2和Cl2混合后,若通入到品红溶液中,品红溶液会褪色;
若通入到BaCl2溶液中,会产生白色沉淀。
C 用淀粉KI试纸检验NO2时,须先用蒸馏水将试纸湿润。
D 铜粉中加盐酸不反应,加适量KNO3晶体后,溶液变蓝。
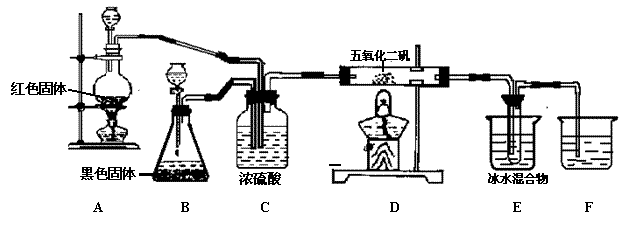
22、(9分)实验室合成SO3的装置如图;试回答
(1)装置B中的黑色固体是:
(2)装置C的作用:
① ;
② ;
③ 。
(3)A处反应的化学方程式:
D处反应的化学方程式:
(4)E中冰水混合物的作用是
四、(本题包括2小题,共17分)
23、(7分)(1)第ⅣA族某元素的单质是一种良好的半导体材料,该元素的金属性比其非金属性强,则该元素是 ,其最高价氧化物的化学式 。
(2)写出工业上制造普通玻璃的主要反应的化学方程式:
(3)高岭石的组成是〔Al2(Si2O5)(OH)4〕若用氧化物的形式来表示,可表示为
。
24、(10分)下表是元素周期表的主族和零族部分,请用相应的化学用语回答有关问题:
| 主族 周期 | ⅢA | 0 | ||||||
| 1 | ||||||||
| 2 | A | B | ||||||
| C | D | E | ||||||
| F | G | H | ||||||
| 5 | J |
⑴A、B的气态氢化物的稳定性是 > 。(用相应化学符号填写,下同)
⑵A、B、C、D的离子半径由大到小的顺序是 。
⑶若E的原子序数为m,则A的原子序数是 ,H的原子序数是 。
⑷C、D、F的最高价氧化物的水化物的碱性强弱顺序是 。
⑸E、G的最高价氧化物的水化物的酸性强弱顺序是 。
⑹C在空气中燃烧产物的电子式是 。
⑺A~J所有元素中,两两相互结合成原子个数比为1∶2的离子化合物的化学式是 。
五、(本题包括1小题,共9分)
25、(9分)已知A为正盐,已知:(1)常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H、I为有色气体,I通常为红棕色气体。(2)F在常温下是一种无色液体。(3)C、J、K的水溶液是一种酸。图中反应条件(除加热外)均已略去。
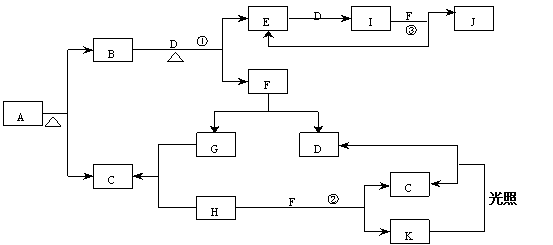 (1)写出A、J、K的化学式A___________,J____________,K_____________。
(1)写出A、J、K的化学式A___________,J____________,K_____________。
(2)写出图中①②③处的化学方程式
①________________________________________________
②________________________________________________
③________________________________________________
六、(本题包括2小题,共13分)
26、(6分)现有碳酸钠和碳酸氢钠的混合物13.7g,加热灼烧至固体质量不再减少后,再跟足量的盐酸反应,放出2.24L二氧化碳(标准状况),计算原混合物中碳酸钠和碳酸氢钠各占多少克?
27、(7分)3.2克铜与过量的硝酸(a mol·L-1, 30ml)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+ 为0.1 mol。
(1)此时溶液中所含NO3—为 mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)
(3)用NaOH溶液吸收产生的气体,原理为:2NO2 + 2NaOH=NaNO3 + NaNO2 +H2O;
NO2 + NO + 2NaOH= 2NaNO2 + H2O。若生成的混合气体能被NaOH被完全吸收,试讨论a的取值范围。
高一化学第二学期期末调研测试
参考答案及评分标准
【评卷说明】
1.所有专业术语、化学用语(符号、化学式等)错误均不给分。
2.化学方程式未配平不给分。
3.文字表达只要答到关键词即可得分。
4.答题中其它合理的说法和解法均可得分。
一、二选择题(1-10题,每小题2分,共20分。11-20题每题3分,共30分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | C | C | D | B | D | D | A | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | D | C | AC | B | AB | C | AC | A | C |
三、(本题包括2题,共11分)
21、(2分)C、D (共2分,错不得分,一个正确给1分)
22、(9分)二氧化锰(MnO2) (1分)
(2)装置(C)的作用:
①干燥气体(或除去混合气体的水蒸气),②观察气体的流速,使SO2与O2以最佳比混合
|
(3)Cu + 2H2SO4 ( 浓 ) ═ CuSO4 + SO2 ↑+ 2H20 (2分)
|
2SO2+O2==== 2SO3(2分)
(4)使SO3冷却成固体 (1分)
四、(本题包括2题,共17分)
 23、(7分)(1)锗(Ge); GeO2 (各1分,共2分)
23、(7分)(1)锗(Ge); GeO2 (各1分,共2分)
(2) Na2CO3+SiO2 Na2SiO3+CO2↑, (2分)
CaCO3+SiO2 CaSiO3+CO2 ↑ (2分)
(3) Al2O3·2SiO2·2H2O (1分)
24、(10分)⑴HF>NH3 (1分)⑵N3->F->Na+>Mg2+(1分)
⑶m-9、m+19(各1分,共2分)⑷KOH>NaOH>Mg(OH)2 (1分)
⑸H2SO4>H3AsO4(1分) ⑹![]() (1分)
(1分)
⑺Na2S、K2S、MgF2、MgBr2(写1个1分,写2个2分,写4个3分)
五、(本题包括1题,共9分)
25、A:NH4Cl J:HNO3 K:HClO (各1分,共3分)

① 4NH3+5O2 4NO + 6H2O(2分)
② Cl2 + H2O = HCl + HClO(2分)
③ 3NO2 + H2O = 2HNO3 + NO (2分)
六、(本题包括题,共13分)
26、(6分)碳酸钠:5.3克 碳酸氢钠:8.4克
解:设Na2CO3物质的量为x,NaHCO3物质的量为y
则:106x+84y=13.7 (1)…………(2分)
x+1/2y=0.1 (2)…………(2分)
x=0.05mol y=0.1mol 所以:碳酸钠质量为5.3g;碳酸氢钠质量为8.4g。(2分)
27、(7分)
(1)利用溶液中电荷守恒:n(NO3-)×1=n(Cu2+)×2+n(H+)×1,
所以:n(NO3-)=0.2……………… (2分);(其他合理解法也给分)
(2)设生成气体中NO2、NO的物质的量分别为X、Y
由得失电子守恒: X+3Y=0.1mol
由“N”元素守恒: X+Y=(0.03a-0.2)mol
X=(0.045a-0.35) mol ; Y=(0.15-0.015a)mol 。……………2分
(共2分,只要列1或2个式子就给1分)
(3)根据题给信息,完全吸收的条件是n(NO2)≥n(NO)时,才可能被完全吸收。
![]() 所以,首先是要保证产生NO、NO2,则列式为①②式:
所以,首先是要保证产生NO、NO2,则列式为①②式:
X>0得:a> 7.8 ①
Y>0得:a<10 ② ……………2分
再由必须完全吸收的条件列③式:
X≥Y得:a≥8.3 ③
所以,三式联立解不等式组,得到a的取值范围为:8.3≤a<10 ………1分