高一化学第二学期期末考试5
试卷
本卷可能用到的相对原子质量:C-12 O-16 Na-23 Si-28 S-32 Ba-137
一、选择题:(每小题只有一个正确答案。普通中学做1~20题,重点中学做3~22题。每小题3分,共60分。)
1、下列物质没有固定熔点的是
A、NaCl
B、干冰
C、玻璃
D、金刚石
2、下列物质中,不与NaOH溶液反应的是
A、二氧化碳
B、石墨
C、二氧化硅 D、氢氧化铝
3、为防治“非典”,日常生活中常用一些消毒剂。下列物质中可作为消毒剂的有
①次氯酸钠 ②过氧乙酸 ③双氧水 ④漂白粉 ⑤含碘食盐 ⑥白醋 ⑦二氧化硫
A、②③④⑤⑥ B、①②③④⑥ C、①③④⑦ D、②③⑤⑥
4、下列物质中,含有极性键的分子是
A、CO2 B、He C、O2 D、NH4Cl
5、下列物质的变化,不能通过一步化学反应完成的是
A、CO2→H2CO3 B、SiO2→Na2SiO3 C、Na2O2→Na2CO3 D、SiO2→H2SiO3
6、下列说法不正确的是
A、为保护臭氧层,可采用减少氟氯代烃的排放量
B、在空气质量报告中,涉及的有:SO2、CO2、NO2、可吸入颗粒物
C、禁止汽车使用含铅汽油是为了避免铅污染大气
D、伊拉克战争造成油井燃烧长时,会对大气造成严重污染并导致雨水酸化
7、某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是
A、S B、C C、Si D、Cl
8、下列气态氢化物中最不稳定的是
A、CH4 B、NH3 C、SiH4 D、H2S
9、下列说法错误的是:
A、 C60、石墨、金刚石三者属于同素异体
B、 长期在二氧化硅粉尘含量较高的地方工作的人易患硅肺病
C、 温室效应主要是由于臭氧层被破坏而造成
D、锗和硒都可用作半导体材料
10、下列各组气体中,既可用浓硫酸干燥又可用碱石灰干燥的是
A、CO H2 CH4
B、H2 O2 Cl2 C、CO
O2 H2S
D、SO2 NH3 CH4
11、下列关于物质性质变化的比较, 不正确的是
A、酸性强弱 HI >
HBr > HCl > HF
B、原子半径大小 Na
> S > O
C、碱性强弱 KOH >
NaOH > LiOH D、还原性强弱 F-> Cl- > I-
12、下列叙述或操作正确的是
A、浓硫酸具有强氧化性,稀硫酸无氧化性
B、浓硫酸不慎沾到皮肤上,应立即用布拭去,再用水冲洗
C、稀释浓硫酸时应将浓硫酸沿着量筒壁慢慢地倒入盛有水的量筒中,并不断搅拌
D、浓硫酸与铜的反应中,浓硫酸仅表现强氧化性
13、 Ba2+
是对人体有剧毒的物质。而医疗上却用BaSO4 作X射线透视肠胃的内服药剂(造影),俗称“钡餐”透视。碳酸钡不可能作“钡餐”使用,这是因为
A、硫酸钡不溶于水,碳酸钡溶于水
B、硫酸钡溶于水,碳酸钡不溶于水
C、硫酸钡是强酸盐,碳酸钡是弱酸盐
D、硫酸钡既难溶于水又难溶于酸,碳酸钡不溶于水但能溶于酸
14、有Na2SO3、AgNO3、Na2SO4、NaHCO3等四瓶溶液,只用一种试剂鉴别,应选用的试剂是
A、Na2CO3
B、NaOH
C、HCl
D、BaCl2
15、两种元素可形成AB2型化合物, 它们的原子序数可能是
A、3和9 B、6和8 C、10和14 D、7和12
16、下列叙述不正确的是
A、化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程
B、由极性键组成的分子是否有极性决定于分子中各键的空间排列
C、原子中核外电子排布的周期性变化是产生元素周期律的根本原因
D、核素就是同位素
17、下列离子方程式,正确的是
A、澄清石灰水中通入过量二氧化碳:Ca2+ +2OH—+CO2 ===CaCO3↓+H2O
B、碳酸钠溶液中加入二氧化硅:CO32—+SiO2==SiO32-+CO2↑
C、二氧化硅与烧碱溶液反应:SiO2 +2OH—=== SiO32—+H2O↑
D、硅酸与烧碱溶液中和:H+ +OH—===H2O
|
A、核内质子数为偶数 B、处于第二周期
C、所在族序数等于L层上电子数 D、可能是0族元素原子
19、在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为
A、36∶30
B、60∶36 C、2∶1
D、1∶2
20、在水溶液中,YO3n- 和S2- 发生的离子反应如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则YO3n- 中Y元素的化合价为
A、+4价 B、+5价 C、+6 价 D、+7价
21、将SO2
通入下列溶液中一定有沉淀生成的是
A.氯水
B.NaOH 溶液 C.BaCl2
溶液
D.Ba(NO3)2
22、有Na2S、Na2SO3
和Na2SO4
的混合物,经测定含硫质量分数为25.6%,则此混合物含氧
A、36.8% B、51.2% C、37.6% D、无法计算
二、填空题:(普通中学做23~26题,重点中学做24~27题)
23、(3分)花岗岩里的正长石的化学式是KAlSi3Ox,x是_______,以氧化物形式表示正长石为 ___________________。
24、(5分)在下列用途或反应中,硫酸表现出的性质为:A.高沸点;B.强酸;C.吸水性;D.脱水性;E.强氧化性。试用字母填空:
(1)实验室制取氢气________________;(2)干燥氢气___________________;
(3)浓硫酸溶解金属铜________________;
(4)浓硫酸可用钢瓶贮运_________;(5)硫酸使蔗糖变黑_______________;
25、(8分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答
(1)元素名称::A ________ B __________ C __________ D ___________
(2)写出AB2 的电子式为 ______________画出D的原子结构简图 _______________,
(3)用电子式表示化合物 C2D 的形成过程
__________________________________
26、(7分)有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3
和CaCO3 ,将固体放入水中,经搅拌后变为无色溶液,在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀全部消失并有气体放出,由此推断:
(1)原固体肯定有_____________________________,
(2)原固体肯定不存在______________________________________。
(3)______________不能确定存在与否,要确定其存在,应进行的实验是___________________________________________________________。
27、(3分)抽取某地酸雨水样进行检验,测得各离子的浓度分别是:[Na+]=2.3×10-5
mol/L
[Cl-]=3.5×10-5mol/L [NH4+]=7.0×10-6mol/L [SO42-]=2.5×10-6mol/L 则该酸雨中[H+]=________。
三、实验题:(普通中学做第28题,重点中学做第29题,本题共9分)
28、(9分)下图是实验室制SO2并验证SO2某些性质的装置图,试回答:
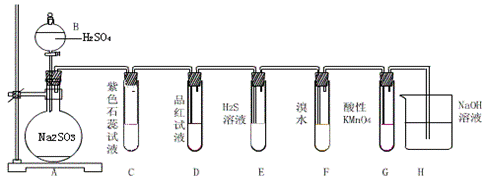
(1)⑥中发生的化学反应方程式为____________________________________________。
(2)①中实验现象为______________证明______________________________________。
(3)②中品红溶液_________,证明SO2有___________。
(4)③中现象是_____________,证明SO2有___________性。
(5)④中现象是_____________,证明SO2有___________性。
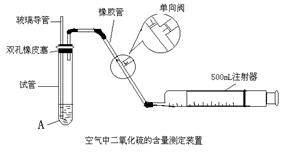 29、(9分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下实验装置:
29、(9分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下实验装置:
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端没在水中),然后 (填写操作方法)时,如看到 (填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.00005mol/L的碘水10mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液配制成溶液A。测定指定地点的空气中的SO2的含量时,推拉注射器的活塞反复抽气,A溶液由色 变为 色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为 。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3)为一级标准0.15,二级标准0.50,三级标准0.70。该学生课外活动小组在某一地点测量空气中SO2的含量,当反应恰好完全时,记录抽气次数为120次(假设每次抽气500mL)。则试通过计算确定该地点的空气中SO2的含量为 ,属于 级标准。
三、计算:
30、(8分)有Na2SO4和Na2CO3 混合液10.0mL,加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、烘干,得到白色沉淀1.45g。将沉淀与过量的盐酸反应,得到112mL(标准状况)CO2 气体,(1)写出有关化学方程式
(2)求原混合溶液中Na2SO4 和Na2CO3 的物质的量浓度。
第二学期期末考试
高 一 化 学 答 卷 纸
一、选择题:(每小题只有一个正确答案。普通中学做1~20题,重点中学做3~22题。每小题3分,共60分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
二、填空题:(普通中学做23~26题,重点中学做24~27题)
23、(3分)
24、(5分)(1) (2) (3) (4) (5)
25、(8分)(1)A
B
C
D
(2)
(3)
26、(7分)(1)
(2)
(3)
27、(3分)
三、实验题:
28、(9分)(1)
(2)
(3)
(4)
(5)
29、(9分)(1)
(2)
(3)
三、计算题:(普通中学做第29题,重点中学做第30题。)
30、(8分)解:
30、(7分)解:
第二学期期末考试
高 一 化 学 答 卷 纸
一、选择题:(每小题只有一个正确答案。普通中学做1~20题,重点中学做3~22题。每小题3分,共60分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | C | B | D | A | D | C | C | C | D | A | D |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B | D | C | B | D | C | B | D | C | D | C |
二、填空题:(普通中学做23~26题,重点中学做23~25、27题)
23、 8 K2O·Al2O3·6SiO2
24、(1) B (2) C (3) B、E (4) E (5) D
25、(1)A 碳
B
氧 C 钠 D 硫
(2) 略(3)略
26、(1) Na2CO3
(2) Na2SO4 CaCl2
CuSO4 CaCO3
(3) NaCl 取少量上述无色溶液加入用HNO3酸化的AgNO3溶液,若出现白色沉淀,则证明有NaCl存在
27、 10-5mol/L
三、实验题:
28、(1) 2NaOH+SO2=Na2SO3+H2O
(2) 石蕊试液变红 SO2的水溶液呈酸性
(3) 褪色 漂白性
(4) 出现淡黄色浑浊 氧化性
(5) 溴水褪色 还原性
29、(1)向外轻轻拉动注射器的活塞,浸没在水中的玻璃导管口有气泡冒出
(2)蓝、无、SO2+I2+2H2O==H2SO4+2HI (3)0.53mg/m3 三级
三、计算:(普通中学做第29题,重点中学做第30题。)
29、解:C(Na2CO3)=0.5mol/L C(Na2SO4)=0.2mol/L
30、解:V(CO2)=1.792L n(Na2CO3)=0.04mol n(NaHCO3)=0.04mol