高一化学第二学期期末考试题
高 一 化 学 试 题
注意:请将第I卷的答案涂在答题卡上,第II卷在答题纸上作答。
可能用到的相对原子质量:
第I卷(选择题,共72分)
一、选择题(本题包括8小题,每小题只有一个选项符合题意,每小题4分,共32分)
1. 下列各项研究,不能解决石油等化石燃料短缺造成的能源危机的是
A.研究开发生物制乙醇的技术 B.研究太阳黑子爆炸释放能量
C.推广使用煤的液化、气化新技术 D.开发利用风能、地热
2.水有下列性质:①水的沸点高于H2S的沸点 ②水的密度大于冰的密度 ③淡水的密度小于海水的密度 ④氨极易溶于水 ⑤水的稳定性高于H2S,其中与氢键无关的是
A.③⑤ B.①② C.①②④ D.③④⑤
3.下列表示核外电子排布的化学用语中,不正确的是
![]()
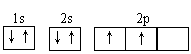 A.S2-离子的结构示意图:
A.S2-离子的结构示意图:
B.基态C原子的电子排布图:
 C.Se原子的简化电子排布式:[Ar]4s24p4
C.Se原子的简化电子排布式:[Ar]4s24p4
D.O原子的电子式: O
4.下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速度
②镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀
③金属冶炼包括:矿石的富集、冶炼和精炼三个步骤
④金属活动性顺序表中排在氢前面的金属较活泼需用电解法冶炼
⑤铝的冶炼常采用电解熔融氧化铝的方法
A.①②③④⑤ B.①③⑤ C.②③⑤ D.②④
 5.从海水中提取镁的主要工艺流程是
5.从海水中提取镁的主要工艺流程是
A.海水 Mg(OH)2 Mg
B.海水 Mg(OH)2 MgCl2 Mg
C.海水 MgCl2 Mg
D.海水 MgCl2 Mg
![]() 6.欲检验有机物HOOC- -CH=CH-CHO中的羧基、碳酸双键和醛基三种官能团,所选试剂及其顺序正确的
6.欲检验有机物HOOC- -CH=CH-CHO中的羧基、碳酸双键和醛基三种官能团,所选试剂及其顺序正确的
A.银氨溶液、溴水、碳酸氢钠溶液
B.酸性KMnO4溶液、新制氢氧化铜悬浊液、氢氧化钠溶液
C.碳酸钠溶液、新制氢氧化铜悬浊液、溴水
D.石蕊试液、银氨溶液、酸性KMnO4溶液
![]() 7.乙醇催化氧化实验是将在酒精灯外焰上加热后的铜丝插入到盛有乙醇的试管中,过一会后试管中的液体突然沸腾,铜丝由黑色变为紫红色,并闻到有刺激性的气味,对于反应:
7.乙醇催化氧化实验是将在酒精灯外焰上加热后的铜丝插入到盛有乙醇的试管中,过一会后试管中的液体突然沸腾,铜丝由黑色变为紫红色,并闻到有刺激性的气味,对于反应:
CuO+CH3CH2OH CH3CHO+Cu+H2O有关能量关系的图像正确的是


![]()
A B C D
![]() 8.一定条件下,在2L闭密容器中充入2mol NO2气体,发生反应2NO2(g) N2O4(g),4min时可逆反应达到平衡,此时,c(NO2)=0.2mol/L,则容器中NO2的物质的量为1.2mol时,所需要的时间为
8.一定条件下,在2L闭密容器中充入2mol NO2气体,发生反应2NO2(g) N2O4(g),4min时可逆反应达到平衡,此时,c(NO2)=0.2mol/L,则容器中NO2的物质的量为1.2mol时,所需要的时间为
A.小于2min B.2min C.大于2min D.无法确定
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个正确的给2分,选两个都正确的给满分,但只要选错一个,该小题就为0分。)
9. 下列各项比较中,正确的是
A.原子半径:P<F B.电负性:As>Br
C.能级能量:4p<3d D.第一电离能:Mg>Al
10.短周期元素X、Y、Z的原子序数依次递增,它们原子的最外层电子数之和为10,X与Z同主族,X原子次外层电子数等于Y原子最外层电子数,则下列叙述正确的是
A.原子半径:X<Y<Z
B.Y的氧化物的熔点比X的氧化物的熔点低
C.X的最低价氢化物的沸点低于Z的最低价氢化物的沸点
D.X与Z可形成离子化合物
11.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.11g D218O中含有的电子数为5NA
B.1mol NaHSO4晶体中,阴、阳离子总数为3NA
C.7.8 g Na2O2与足量的CO2反应,转移的电子数为0.2NA
D.标准状况下,5.6L CH4分子中共价键总数为NA
12.下列叙述中正确的是
A.二氧化硅坚硬,主要是由于它们的分子间作用力大
B.金属离子核外都一定满足最外层2或8电子结构
C.晶体硅熔化,需要克服共价键作用,因而熔点高
D.电子所处能级的能量越高,电子离核就一定越远
13.铅蓄电池是一种仍在普遍使用的二次电源,放电时,它是由Pb、PbO2和稀硫酸构成的原电池。下列有关铅蓄电池的说法中正确的是
A.PbO2能导电,作原电池的正极
B.放电时,溶液中的SO42-只向负极移动
C.放电时,溶液中的H+只向正极移动
D.用铅蓄电池电解熔融氧化铝,若得到金属铝5.4g,铅失去电子0.4mol
14.下列有关反应式书写正确的是
![]() A.钢铁发生吸氧腐蚀的正极反应式:O2+2H2O+4e-===4OH-
A.钢铁发生吸氧腐蚀的正极反应式:O2+2H2O+4e-===4OH-
B.甲苯、氯气光照条件下发生侧链上的取代反应:2 -CH3+Cl2→2 -CH2Cl+H2
C.甲醇催化氧化的化学方程式:2CH3OH+O2 2HCHO+2H2O
D.醋酸与氢氧化铜反应的离子方程式:2H++Cu(OH)2===Cu2++2H2O
15.为实施2008北京“科技奥运”战略,兴奋剂检测生物芯片将在2008年北京奥运会上首次“大显身手”。国际奥委会公布的违禁药物目前有138种,麻黄碱是禁止使用的兴奋剂之
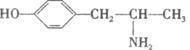 |
一,其结构简式如下: ,下列关于它的说法正确的是
A.它的分子式是C9H13NO B.该物质属于高分子化合物
C.从结构上看,它属于氨基酸 D.一定条件下可发生取代反应
16.根据下列五种元素的电离能数据(单位:kJ/mol),判断下列说法不正确的是
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.元素的电负性最大的可能是Q元素 B.R和S均可能与U在同一主族
C.U元素可能在周期表的s区 D.原子的价电子构型为ns2np1的可能是T元素
![]()
![]()
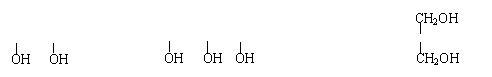 17.液态饱和多元醇都能与金属钠反应放出氢气,产生等质量的氢气消耗乙二醇、丙三醇、季戊四醇(结构简式如下)的物质的量之比为
17.液态饱和多元醇都能与金属钠反应放出氢气,产生等质量的氢气消耗乙二醇、丙三醇、季戊四醇(结构简式如下)的物质的量之比为
乙二醇 CH2-CH2 丙三醇 CH2-CH-CH2 季戊四醇 HOCH2-C-CH2OH
A.2∶3∶4 B.4∶3∶2 C.6∶4∶3 D.6∶3∶2
18.某物质的分子组成为CxHyOz,取该物质m g在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,充分反应后,其固体的质量也增加m g,则该物质的分子组成必须满足
A.x=y=z B.x=y C. y=z D.x=z
第II卷(非选择题,共78分)
三.实验题:(本题共18分)
19.下列实验方案的设计正确的是_______________(填序号)
A.在强酸、强碱反应的中和热测定中,把量筒中的NaOH溶液分几次缓慢倒入盐酸中
B.将碘酒滴到土豆上,可检验土豆中含有淀粉
C.煤干馏得到煤焦油的分离采用分馏的方法
D.利用浓硝酸遇蛋白质微热变黄色的性质,可对部分蛋白质进行检验
E.乙烷中混有乙烯,可先通入足量氢气,在Ni作催化剂条件下共热除去乙烯
F.除去乙酸乙酯中混有的乙酸,加入饱和Na2CO3溶液,振荡后,静置分液
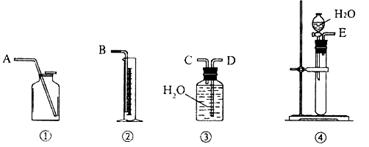
20.(12分) 某研究性学习小组的同学为测定含CaO杂质的CaC2试样中CaC2的纯度,设计了以下两种实验方案。请你参与他们的实验与研究:
Ⅰ:第一种方案
实验原理:根据生成乙炔气体的体积,测定CaC2试样的纯度。
实验操作:(1)用下图所示装置组合实验时,所选装置的连接顺序应是: (填各接口的字母)。
(2)若实验时称取的试样为1.40 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为 。
 |
Ⅱ:第二种方案
实验原理:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。
实验操作:先称取试样1.60 g,将试样加入锥形瓶中,称得锥形瓶和试样的质量为96.60g,再向锥形瓶中加入100 mL水,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g | |
| 第1次 | 196.30 | |
| 第2次 | 196.15 | |
| 锥形瓶十水十试样 | 第3次 | 196.05 |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
(3)计算CaC2的质量分数时,必需用的数据是 。
(4)不必作第6次读数的原因是 。
Ⅲ:比较上述实验方案后,请你设计测定CaC2的质量分数的第三种方案。
(5)实验原理:___________________________________________________________。
(6)实验操作:___________________________________________________________。
四、填空题:(本题共42分)
21.淀粉是绿色植物光合作用的产物,也是人类重要的食物之一。
(1)淀粉属于_______________(填写有机物类别)物质,在淀粉酶的作用下发生_________反应而生成葡萄糖,该反应的化学方程式为________________________________________。
(2)葡萄糖在工业上有着广泛的用途,列举两例____________________________________,葡萄糖在血液里称为“血糖”,葡萄糖在人体内发生氧化反应而释放能量,写出该反应的方程式_____________________________________________________________________。
(3)心脏病患者往往心血供应不足。为刺激心脏的收缩常使用心脏起搏器,用于该医疗电器的锂电池寿命可达十年以上。锂电池的负极材料是______________,电解质溶液_______(能、不能)用水溶液,锂电池寿命长的原因是______________________________________。
22.五种短周期元素A、B、C、D、E原子序数依次增大。A元素的最高正价与最低负价的代数和为2,B、E同主族,C元素原子核外电子占据六个原子轨道,且有1个未成对电子,D元素的原子的中子数比质子数多1,0.1mol D元素的单质与足量的稀H2SO4反应,产生的气体在标准状况下的体积为3.36L,E与C形成阴、阳离子个数比为1……2的化合物,推断并回答:
(1)元素D在周期表里的位置______________,E原子的电子排布式为_____________。
(2)A的单质的结构式_________________,用电子式表示A的氢化物的形成过程_______
_________________________。
(3)B元素原子的电子排布图__________________,A的第一电离能大于B的第一电离能的原因_____________________。
(4)D的最高价氧化物对应水化物与E的最高价氧化物对应水化物发生反应的离子方程式___________________________。
23.有机物A、B、C具有相同的分子式。取14.8g有机物B在足量的氧气中燃烧,可生成CO2 0.6mol、H2O 10.8g,已知B的蒸气密度是相同条件下氢气的37倍。
(1)有机物A的分子式为___________,若A能与Na2CO3溶液反应产生气体,则A的结构简式为____________________。
(2)有机物B既能与NaOH溶液发生反应,又能在稀硫酸、加热条件下发生反应,生成两种相对分子质量相同的有机物,则B的结构简式这________________。
(3)有机物C中加入金属钠有气泡产生,加入银氨溶液,水强加热会产生银镜,结构测定分子中不含-CH3,则有机物C的结构简式为___________________,有机物C与O2在Ag作液化剂,加热条件下反应的化学方程式为________________________________________。
24.某地刚出土的文物表面附着一种固体A,实验证明它有下图所示的转化关系。其中F和H是用途十分广泛的两种金属,G是一种黑色化合物,D、E都是常见的非金属单质。
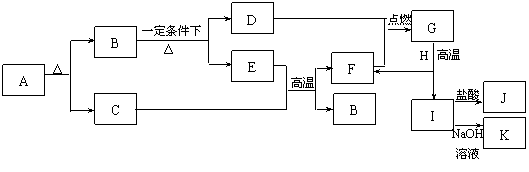
试回答下列问题:
(1)组成A的元素有_________________(写元素符号)。
(2)G+H反应的化学方程式为:______________________________________________。
I→K反应的化学方程式为:______________________________________________。
(3)含有杂质碳的F有潮湿空气中可以形成A,试用反应式表示F形成A的变化过程:
___________________________________; ___________________________________;
___________________________________; ___________________________________。
五、计算题:(本题共18分)
25. 一定条件下,某有机物在足量O2中燃烧,只产生CO2和水蒸气。若将产物通过足量的澄清石灰水,得到白色沉淀30g;若将产物通过足量的碱石灰,碱石灰增重18.6g。
(1)若有机物的质量为4.2g,求该有机物分子的实验式。
(2)若有机物的质量为5.8g,且其物质的量为0.1mol,求该有机物化学式。
26.乙炔与氢气在催化剂Ni的作用下逐步加成生成乙烯、乙烷。现有标准状况下的丙炔(CH3-C≡CH)与氢气的混合气体13.44L,通入装有催化剂Ni的装置中,充分反应。
(1)写出发生反应的化学方程式。
(2)设混有气体中H2的物质的量为x,当x取不同值时,推断所得气体的成分,计算所得气体在标准状况下的体积V(可以用含“x”的代数式表示),请填表回答:
| x值 | 所得气体成分(化学式) | 所得气体体积V(L) |
(3)在下面的坐标中,画出V随x值变化的曲线。
第二学期期末考试
高 一 化 学 答 题 纸
三.实验题:(本题共18分)
19.
四、填空题:(本题共42分)
五、计算题(本题共18分)
25.