第五章第二节 元素周期律练习题
一、作业
1.下列各组元素性质递变规律不正确的是
A.Li、Be、B原子随原子序数的增加最外层电子数依次增多
B.P、S、Cl元素最高正价依次增高
C.N、O、F原子半径依次增大 D.Na、K、Rb的金属性依次增强
2.元素性质呈周期性变化的原因是
A.相对原子质量逐渐增大 B.核电荷逐渐增大
C.核 外电子排布呈周期性变化 D.元素的化合价呈周期性变化
3.已知某元素R的气态氢化物的化学式为H2R,下列叙述中不正确的是
A.该元素的原子最外电子层上有6个电子
B.该元素的是了高正价氧化物的化学式为RO2 C.该元素一定是非金属元素
D.该元素最高价氧化物对应的水化物的化学式为H2RO4
4.X和Y两种元素的原子,在化学反应中都易换去两个电子形成稳定结构,已知X的原子半径小于Y的原子半径,下列说法正确的是
A.两种原子失去电忆的能力相同 B.两种原子的核 外具有相同的电子层数
C.Y(OH)2的碱性比X(OH)2的碱性强 D.Y的金属性比X的金属性强
5.下列各组元素中原子序数按由小到大顺序排列的是
A.Be、C、B B.Li、O、Cl C.Al、S、Si D.C、S、Mg
6.原子序数11~17号的元素,随核电荷数的递增而逐渐变小的是
A.电子层数 B.最外层电子数 C.原子半径 D.元素最高化合价
7.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物
A.NaOH B.Al(OH)3 C.LiOH D.RbOH
8.下列各组元素中,原子半径依次增大的是
A.Al、Si、P B.I、Br、Cl C.O、S、Na D.Mg、Ca、Ba
9.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正
确的是
A.X的原子序数比Y的小 B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大 D.X元素的最高正价比Y的大
10.价电子数为1的X原子和价电子数为6的Y原子,形成化合物的化学式可能是
A.XY2 B.XY C.X2Y D.X2Y3
11.2种元素可形成AB2型化合物,它们的原子序数是
A.3和9 B.6和8 C.10和14 D.7和12
12.已知X、Y均为1—18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则这两种元素的原子序数之和为
A.19 B.18 C.16 D.9
13.下列各组元素中,按最高正价递增顺序排列的是
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na、K、Rb
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
14.在1~18号元素中(稀有气体元素除外):(1)原子半径最小的元素是________;(2)原子半径最大的元素是________;(3)非金属性最强的元素是________;(4)金属性最强的元素是________;(5)最高价氧化物对应水化物中碱性最强的物质是________,它对应的氧化物的化学式为________;(6)最高价氧化物对应水化物中酸性最强的物质是________,它对应的氧化物的化学式为________;(7)气态氢化物中最稳定的物质是________;(8)气态氢化物中最不稳定的物质是________.
15.主族元素R的气态氢化物化学式是RH4,它的最高价氧化物的式量与气态氢化物的式量之比是2.75∶1,R的原子量是________。
16.在原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)在室温下有颜色的气体单质是_____________。
(4)在空气中容易自燃的单质名称是_____________。
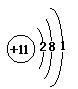
(5)除稀有气体外,原子半径最大的元素是_____,它的原子结构示意图是__________。
(6)原子半径最小的元素是_____________。
(7)气态氢化物水溶液呈碱性的元素是_____________。
(8)气态氢化物最稳定的物质的化学式是_____________。
(9)最高价氧化物对应水化物的酸性最强的元素是_____________。
二、练习
15.同周期的X、Y、Z三种元素,已知如下关系:HXO4、H2YO4、H3ZO4的酸性依次减弱,则下列判断正确的是
A.原子半径X最大Z最小 B.非金属性X最强Z最弱
C.气态氢化物的稳定性HX最强 D.三种元素的原子得电子形成阴离子,X-的还原性最强
16.X和Y两种元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和X两种元素的原子核外电子层数相同,Z元素的原子半径小于X元素的原子半径,X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X
17.能说明氯的非金属性比硫强的事实是
A.氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B.向硫化氢的水溶液中通入氯气可得到淡黄色的硫 C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
18.X、Y两种元素的原子,当它们分别获得一个电子后,都形成稀有气体原子的电子层结构,且X放出的能量大于Y,下列叙述正确的是
A.X-的还原性大于Y- B.Y的氧化性大于X
C.X的原子序数小于Y D.X-的原子半径小于Y-
19.能说明A元素的非金属性比B元素的非金属性强的是
A.A原子得到电子的数目比B原子少
B.A元素的最高正价比B元素的最高正价要高
C.气态氢化物溶于水后的酸性:A比B强
D.A单质能与B的氢化物水溶液反应,生成B单质
20.元素性质呈现周期性变化的基本原因是
A.元素的原子量逐渐增大 B.核外电子排布呈周期性变化
C.核电荷数逐渐增大 D.元素化合价呈周期性变化
21.下列各组气态氢化物的稳定性按由强到弱的顺序排列的是
A.HI、HCl、H2S、PH3 B.PH3、H2S、HCl、HBr
C.HF、HCl、H2S、SiH4 D.NH3、PH3、H2S、HCl
22.某元素X的气态氢化物化学式为H2X,下面的叙述不正确的是
A.该元素的原子最外电子层上有6个电子 B.该元素最高正价氧化物的化学式为XO2
C.该元素是非金属元素 D.该元素最高正价氧化物对应水化物的化学式为H2XO4
23.电子层数相同的3种元素X、Y、Z已知最高价氧化物对应水化物的酸性HXO4
>H2YO4>H3ZO4则下列判断错误的是
A.原子半径X>Y>Z B.气态氢化物稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z D.气态氢化物还原性HX<H2Y<ZH3
24.下列各组中,在一定条件下前面的元素可以把后面的元素从其化合物的溶液中置
换出来的是
A.Cu、Fe、Ag B.Cl、Br、I C.Na、Cu、Hg D.F、Br、I
25.下列物质中,既能与强酸又能与强碱反应的是
①Na2CO3 ②NaHCO3 ③Al2O3 ④Al(OH)3
A.①②③④ B.①②③ C.①②④ D.②③④
26.元素R的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中,R元素的化合价为
A.12-3n B.3n-12 C.3n-10 D.6-3n
27.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
A.6和8 B.11和13 C.11和16 D.12和17
28.甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强; ④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是
A.只有④ B.只有⑤ C.①②③ D.①②③④⑤
29.下列微粒半径之比大于1的是
A.r(K+)/r(K) B.r(Ca)/r(Mg) C.r(P)/r(S) D.r(Cl)/r(Cl-)
30.A.B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是
A.n+4 B.n+6 C.n+8 D.n+10
31.质量数为32,核内有16个中子的原子R,能形成的粒子组是
A.R2+、RO2、RO3 B.R2-、RO2、RO3
C.R-、RO![]() 、R2O
、R2O![]() D.R+、RO、RO
D.R+、RO、RO![]()
32.某金属阳离子M2+所带电荷与微粒质量比为8.04×103C/g。已知每个电子所带的
电量为1.6×10-19C,则此金属相对原子质量为
A.24 B.40 C.64 D.65
34.下列叙述中,肯定a金属比b金属活泼性强的是
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
34.A、B、C三种元素的原子具有相同的电子层数,它们相同物质的量的原子获得相同物质的量的电子时释放出的能量是A>C>B,则它们原子序数大小顺序是 A.B>C>A B.A>B>C C.B<A>C D.A>C>B
35.已知An+、B(n-1)+、C(n+1)+、D(n+1)-都有相同的电子层结构,A、B、C、D的原子半径由大到小的顺序是
A.C>D>B>A B.A>B>C>D C.B>A>C>D D.A>B>D>C
36.Y元素最高正价与负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是
A.KCl B.Na2S C.Na2O D.K2S
37.下列递变规律不正确的是
A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
38.下列各组物质的性质变化正确的是
A.酸性HClO4>HNO3>H3PO4>H2SiO4 B.稳定性H2S>HCl>HBr>HI
C.熔点Rb>K>Na>Li D.溶解性NaHCO3>Na2CO3>NaOH
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 | ||||||||||||
| 题号 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 |
| 答案 |
二、填空题:
39.现有A、B、C三种元素,已知B原子序数大于A,A与B的质子数之和为27,质子数之差为5,0.9gC单质与足量盐酸作用 放出标态下1.12L氢气,同时生成C的三氯化物,回答下列问题
(1)A是 ,B是 , C是 。
(2)排出三种元素最高价氧化物对应的水化物酸碱性强弱顺序
40.今有A、B、C、D四种短周期元素,它们的核电荷数依次增加,A与C、B与D分别是同族元素,B、D两种元素的质子数之和是A、C两种元素的质子数之和的两倍,这四种元素中有一种元素的一种原子无中子,则四种元素是:
A , B ,C ,D 。
41.主族元素M的原子最外层有6个电子,它在其气态氢化物中的含量是89%,M的原子量是________。
42.写出下列反应的化学方程式
(1).铝和稀盐酸反应
(2).氯化铝溶液和适量烧碱溶液反应生成氢氧化铝
(3).氢氧化铝和烧碱溶液反应
(4).氢氧化铝和稀盐酸反应
43.推断题:已知A、B两种元素,A能形成A2O2的氧化物,其中A的质量分数为70.91%;B的阴离子结构与氪原子结构相同,B单质在常温下是一种易挥发的液态物质,B的氢化物水溶液是强酸.通过计算和推理回答A、B各是什么元素。
44.在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为___________。
45.元素周期律是指元素的性质随___________的递增,而呈_______性变化的规律,
这里元素的性质主要是指_____________和_____________;元素性质周期性变化是
__________________________呈周期性变化的必然结果。
46.有下列四种微粒:①![]() O、②2311Na、③
O、②2311Na、③![]() Mg、④
Mg、④![]() N
N
(1)按原子半径由大到小顺序排列的是__________________________
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________,能形成X3Y2型化合物的是___________。
47.有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。
B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状况下放出2.24LH2。D的M层上有7个电子。则A、B、C、D各是什么元素。
A_____________B_____________C_____________D_____________
48.A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原
子的电子总数比B原子电子总数多4。1 molA的单质跟盐酸反应可置换出11.2L(标
准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A是_________元素,B是___________元素,C是___________元素。
(2)分别写出A、B最高正价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:_____________________________________________________________。
(3)A离子的氧化性比B离子的氧化性 _____________,这是由于_____________。
三、计算题:
49.A、B两金属元素混合物6.3g,其中A、B两元素原子个数比为3:2,最高化合
价之比为2:3,用足量的盐酸处理6.3g混合物,使之全部溶解,收集到标准状况下的
氢气6.72L,又知B的相对原子质量是A的相对原子质量的1.125倍,通过计算求A.B
两元素的相对原子质量。
50.某元素及其气态氢化物化学式为H2R,其高价氧化物中氧的质量分数是60%,求元素R的相对原子质量?
51.往10mL浓度为1mol•L-1的AlCl3溶液中,加入35mL等物质的量浓度的NaOH溶液.充分反应后,过滤、干燥可得白色固体多少克?
参考答案
1 C、2C、3B、4CD、5B、6C、7A、8CD、9BC、10C、11B、12A、13B、14.(1)H;(2)Na;(3)F;(4)Na;(5)NaOH、Na2O;(6)HClO4、Cl2O7;(7)HF;(8)SiH4.15.12
16.(1)Na(2)F2(3)Cl2(4)白磷(5)Na;(6)H(7)N (8)HF(9)Cl
|
39.钠、硫、铝。H2SO4、Al(OH)3、NaOH。
40.氢、氧、钠、硫。
41.16. 43.(1).2Al+6HCl=2AlCl3+3H2↑. (2).AlCl3+3NaOH=Al(OH)3↓+3NaCl.(3).Al(OH)3+NaOH=NaAlO2+2H2O.(4).Al(OH)3+3HCl=AlCl3+3H2O
44.K、Br 46.H<F<O<N<C<Li<Na<K
47.原子序数;周期性;原子半径;化合价;核外电子排布
48.(1)②>③>④>① (2)① (3)④ (4)①②;③④
49.O; Na; Mg;Cl
50.(1)Na;Al;Cl(2)OH-+H+=H2O Al(OH)3+3H+=Al3++3H2O(3)弱;半径大、电荷少。
51.由题意:![]() 且 A化合+2 B离子为+3价
且 A化合+2 B离子为+3价
A~H2↑ 2B~3 H2↑
n(A)→n(A) n(B)→1.5n(B)
∴![]() 且n(A)+1.5n(B)=0.3mol
且n(A)+1.5n(B)=0.3mol
∴n(A)=0.15mol, n(B)=0.1mol
![]()
![]() 0.15×Mr(A)+0.1×Mr(B)=6.3
Mr(A)=2
0.15×Mr(A)+0.1×Mr(B)=6.3
Mr(A)=2
∴ Mr(B)/Mr(A)=1.125 Mr(B)=27
52.32.
53.0.39g