高一第二学期调研考试化学试卷(三)
命题人:彭正荣
注意:本次考试时间为100分钟,卷面成绩为120分
可能用到的相对原子质量:H 1,C 12,N 14,O 16
第Ⅰ卷 选择题共49分
一.选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意。)
1. 下列分子式表示的物质一定是纯净物的是
(A) C5H10 (B) C7H8 (C)CH4O (D)C2H4Cl2
2.某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是
A. 分子中的C、H、O的个数比为1:2:3 B. 分子中C、H个数比为1:2
C. 该有机物的相对分子质量为14 D. 该分子中肯定不含氧元素
 3.已知A物质的分子结构简式如下,lmol A与足量的
3.已知A物质的分子结构简式如下,lmol A与足量的
NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为
A.6mol B.7mol C.8mo1 D.9mo1
4.下列5种烃:①2-甲基丙烷;②乙烷;③丙烷;④丁烷;⑤戊烷。按它们的沸点由高到低的顺序排列正确的是
A.①②③④⑤ B.⑤④①③② C.④⑤②①③ D.③①②⑤④
5.某烯烃CH2=CH-C(CH3)3的名称叫“3,3-二甲基-1-丁烯”。该烯烃跟氢气催化加氢后所得到的产物的名称叫
A.3,3-二甲基丁烷 B.2,2-二甲基丁烷
C.1,1,1-三甲基丙烷 D.1,1-二甲基丁烷
二、选择题(本题包括10小题,每小题3分,共39分。每小题有一个或两个选项符合题意。)
6.1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.乙炔 B.丙炔 C.丁炔 D.丁二烯
7. 有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列各项的事实不能说明上述观点的是
A.甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色
B.乙烯能发生加成反应,而乙烷不能发生加成反应
C.苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应。
D.乙烷在光照条件下能发生取代反应,而乙炔不能发生取代反应。
8.将 转变为 的方法为:
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
9.某饱和一元醇与浓硫酸共热得一种无同分异构体的烯烃,该醇分子中的碳原子数为
A.l B.2 C.3 D.4
10.某有机物的结构简式为![]() ,它可以发生反应的类型有
,它可以发生反应的类型有
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A.①②③④ B.①②④⑤ C.①②⑤⑥ D.③④⑤⑥
11.某有机物的分子式为C5H10O,它能发生银镜反应和加成反应,若将它与H2加成,所得产物的结构简式可能是
A.(CH3)3CCH2OH B.(CH3CH2)2CHOH
C.CH3(CH2)3CH2OH D.CH3CH2C(CH3)2OH
12..可用来鉴别乙烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A.氯化铁溶液、溴水 B.碳酸钠溶液、溴水
C.酸性高锰酸钾溶液、溴水 D.酸性高锰酸钾溶液、氯化铁溶液
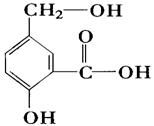
13.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性,物质CH3COOCH2―CH―CHO
有光学活性,发生下列反应后生成的有机物仍然有光学活性的是 。
A.与乙酸发生酯化反应 B.与NaOH水溶液共热
C.与银氨溶液作用 D.在催化剂存在下与氢气作用
14.以下实验能获得成功的是
A.用酸性KMnO4溶液鉴别乙烯和乙炔
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝的酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
15.下列各组有机物中,当两种有机物以任意比例混合后充分燃烧,所得的CO2和H2O的物质的量总是相等的是
A.乙醇、乙醚 B.乙烯、丁烯
C.苯、苯酚 D.丙烯酸、油酸
16.完全燃烧2.00 g有机物,可生成4.40 g CO2和1.44 g H2O,则该有机物的化学式为
(A) C5H8 (B) C5H8O (C) C5H8O2 (D) C10H16O4
17.甲醛、乙酸和丙醛组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为
(A) 27% (B) 28% (C) 54% (D) 无法计算
18.某有机物分子中含有n个-CH2-,m个-CH-,a个-CH3,其余为-OH,则羟基的个数为
A.2n+3m-a B.m+2-a C.n+m+a D.m+2n+2-a
第II卷(非选择题,共71分)
三.(本题包括3小题,共22 分)
19.有机化学中取代反应范畴很广,下列6个反应中,属于取代反应范畴的是(填写相应的字母) 。
浓硫酸
![]()
![]() A. +
HNO3 ───→ ―NO2
+ H2O
A. +
HNO3 ───→ ―NO2
+ H2O
50~60℃
![]() B.CH3CH2CH2CHCH3
B.CH3CH2CH2CHCH3![]() CH3CH2CH=CHCH3 + H2O
CH3CH2CH=CHCH3 + H2O
OH
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.(CH3)2CHCH=CH2 + HI → (CH3)2CHCHICH3 + (CH3)2CHCH2CH2 I
(多) (少)
E.CH3COOH
+ CH3CH2OH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
RCOOCH2 CH2OH
![]()
![]()
![]()
![]() F.RCOOCH+ 3H2O
F.RCOOCH+ 3H2O
![]() 3RCOOH + CHOH
3RCOOH + CHOH
RCOOCH2 CH2OH
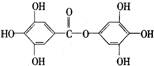
20.在某有机物A的分子中,具有酚羟基、醇羟基、 羟基等官能团,其结构简式如下图。
 ①A跟NaOH溶液反应的化学方程式是
①A跟NaOH溶液反应的化学方程式是
②A跟NaHCO3溶液反应的化学方程式是
③A在一定条件下跟Na反应的化学方程式是:
。
21.(1)写出下列微粒的电子式:
CH3- (2)-OH (3)C2H2 (4)OH–
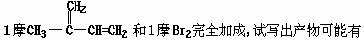 |
(2)
的结构简式:
(3)在乙醛溶液中滴入酸性KMnO4溶液,可观察到的现象是
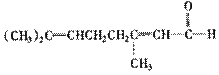 |
现知柠檬醛的结构简式 ,若要检出其中的碳碳双键,
其方法是 。
(4)在实验室进行醛的银镜反应实验时,所用的银氨溶液应随用随配,不能久置。配制银氨溶液的方法是 (不要求浓度和溶液的体积)乙醛银镜反应方程式 。
 四、(本题包括2小题,共17 分)
四、(本题包括2小题,共17 分)
22.(1)分离苯和苯酚的混合物,应该采取的实验方法,
(2)检测卤代烃中的卤素原子的实验方法,
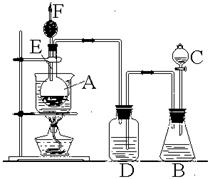
23.右图是某化学课外活动小组设计的乙醇
与氢卤酸反应的实验装置图。在烧瓶A中放一
些新制的无水硫酸铜粉末,并加入约20 mL无水
乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和
广口瓶D中分别盛浓硫酸;干燥管F中填满碱
石灰;烧杯作水浴器。当打开分液漏斗的活塞后,
由于浓硫酸流入B中,则D中导管口有气泡产生。
此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,点燃气体,有绿色火焰。试回答:
(1)B中逸出的主要气体是(填名称)_______________________;
(2)D瓶的作用是______________________;
(3)E管的作用是_______________________;
(4)F管口点燃的气体是(填分子式)___________________(5)A瓶中无水硫酸铜粉末变蓝的原因是_____________________________________;
(6)由A中发生的反应事实,可推断出的结论是______________________ ____
五、(本题包括2小题,共18分)
24.通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构: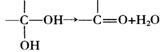
下图是9个化合物的转变关系:
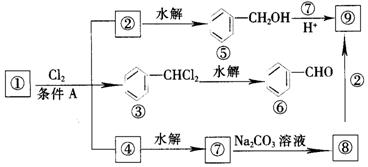
(1)化合物①是 ,它跟氯气发生反应的条件A是 。
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨,⑨的结构简式是 ,名称是 。
(3)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它,此反应的化学方程式是 。
25.化学式为C9H10O2的有机物有如下的转化关系:
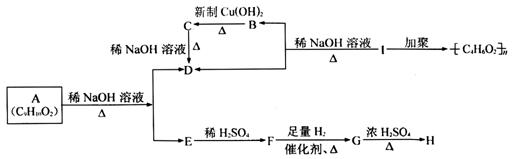 |
其中F与FeCl3溶液能发生显色反应,从G到H的反应中,有机产物只有一种结构且能使溴水褪色。
(请注意:当烃基与双键碳原子相连接时,易发生如下转化:)
请回答下列问题:
(1)结构简式:D H I 。
(2)G→H的反应类型:
(3)A生成D和E的化学方程式:
(4)B→C化学方程式:
六.(本题包括2小题,共14分)
26.现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知A和B碳原子数均不大于4,且A<B。
(1)混合物中A可能的分子式 。
(2)若n(A):n(B)=1:1时, B可能的名称 。
(3)若n(A):n(B)≠1:1时, B可能的结构简式为
则n(A):n(B)= 。
27、在4000C,101.3k Pa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积(m+6)L(气体体积均在同温同压下测定)试回答下列问题:
(1)通过计算说明,烃A的组成中应满足的条件。
(2)通过计算推断,当m=27时,烃A可能的分子式(只要求写出三种可能的分子式)。三种可能的分子是: , , 。
(3)通过计算确定,若烃A在常温常压下为气态物质时,m的取值范围。
第二学期高一调研考试(三)
化学答卷 命题人:彭正荣
一、二选择题(共49分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、(本题包括3小题,共22分)
19、
20、①
②
③
21、(1)
(2)
(3)
(4)
四、(本题包括2题,共17分)
22、(1)
(2)
23、(1) (2)
(3) (4)
(5)
(6)
五、(本题包括2小题,共18分)
24、(1)
(2)
(3)
25、(1)
(2)
(3)
(4)
六、(本题包括2小题,共14分)
26、(1) (2)
(3)
27、(1)
(2) , ,
(3)