高一第二学期期末考试化学试卷
第I卷
一、选择题(本题有10小题,每小题只有一个选项符合题意)
1、下列各微粒中, 核外电子总数相等的是 ( )
A. CO2 和 NO2 B. N2 和 CO2 C. NH4+ 和 H3O+ D. H2S 和 H2O
2、某些保健品中有锗元素,则有关锗的叙述正确的是 ( )
A. 锗在周期表的第三周期第IVA族
B. 锗的金属性比钠强
C. 锗的原子序数为34
D. 单质锗是半导体
3、2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是 ( )
A.Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds为金属元素
4、下列叙述中,正确的是 ( )
A.不久前俄美科学家用实验方法得到了115号元素,其质量数是115
B.Cu与浓硫酸的反应说明了浓硫酸既具有氧化性又具有酸性
C.碳酸钠在水中的溶解度比碳酸氢钠小
D.任何原子核都是由质子和中子组成的
5、光纤通讯是一种现代化通讯手段,制造光导纤维的主要原料是 ( )
A. CaCO3 B. CaO C. SiO2 D. CaSiO3
6、据报道,上海某医院正在研究用放射性同位素碘![]() 治疗肿瘤。该同位素原子核内的中子数与核外电子数之差是
(
)
治疗肿瘤。该同位素原子核内的中子数与核外电子数之差是
(
)
A.72 B.19 C.53 D. 125
7、下列反应中,调节反应物的用量或物质的量浓度,不会改变反应产物的是( )
A、碳在氧气中燃烧
B、铁丝在硫蒸气中燃烧
C、二氧化硫通入石灰水
D、硫酸中加入锌粉
8、下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A、H2O B、BF3
C、CCl4 D、PCl5
9、既可以在强酸性条件下大量共存又能在强碱性条件下大量共存的离子组是( )
A、Al3+、Na+、NO3— 、Cl—
B、K+、Na+、Cl—、NO3—
C、K+、Na+、Cl—、SO32—
D、K+、Na+、I—、Fe2+
10、工业上从含硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸(H2SeO3)和少量硒酸(H2SeO4),再加入盐酸共热,硒酸被转化为亚硒酸,反应方程式为2HCl+H2SeO4=H2SeO3+Cl2+H2O,然后再将SO2通入亚硒酸中,单质硒析出。据此,判断下列叙述中正确的是 ( )
A、H2SeO4氧化性弱于Cl2
B、H2SeO3氧化性强于H2SO3
C、H2SeO3氧化性弱于SO2
D、析出1molSe需H2SeO3、SO2、H2O各1mol
二、选择题(本题包括10个小题,每小题有1个或2个选项符合题意。)
11、X、Y、Z和R分别代表四种元素。如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素原子序数),则下列关系正确的是 ( )
A. a-c=m-n B. a-b=n-m
C. c-d=m+n D. b-d=n+m
12、根据下列各组元素的原子序数,可组成化学式为AB2型化合物且为离子化合物的是
( )
A. 14和6 B. 14和8 C. 12和17 D. 6和8
13、不能由单质直接化合而得到的化合物是 ( )
A. FeCl3 B. SO2 C. CuS D. FeS
14、1999年曾报导合成分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是 ( )
A、N5+共有34个核外电子
B、N5+中氮—氮原子间以共用电子对结合
C、化合物N5AsF6中As化合价为+1
D、化合物N5AsF6中F化合价为—1
15、x、y、z是三种主族元素,如果xm+与yn—具有相同的电子层结构,zn—半径大于yn—半径,则三种元素的原子序数由大到小的顺序是 ( )
A、z >x>y B、x>y>z
C、z>y>x D、x>z>y
16、下列各组溶液,只有组内溶液相互反应就能鉴别的是 ( )
A、Na2SO4、BaCl2、KNO3、NaCl
B、Na2SO4、Na2CO3、BaCl2、HCl
C、NaCl、Na2SO3、NaNO3、HCl
D、HCl、Na2CO3、Na2S、BaCl2
17、在50mlAl2(SO4)3溶液中,加入Cl—离子浓度为0.8mol·L—1的BaCl2溶液75ml,恰好使SO42—离子完全变成沉淀,则Al2(SO4)3溶液中Al3+离子的物质的量浓度为( )
A、0.6mol·L—1 B、0.4mol·L—1
C、0.3mol·L—1 D、0.2mol/L
18、mgCu与足量浓H2SO4完全反应,在标准状况下得到nLSO2,则被还原的H2SO4的量不正确的是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
19、某短周期元素的最外层有2 个电子,则这种元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素
20.下列说法正确的是 ( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
第II卷
21、图虚线框中的装置用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白
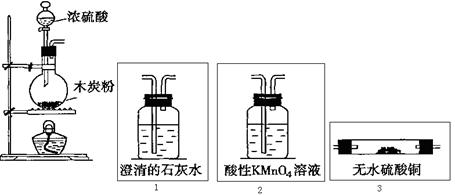
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是_____________,不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是___________,不能检出的物质是_____________。
(3)如果将仪器的连接顺序变为②、③、①,则可检出的物质是___________,不能检出的物质是_____________。
22、为了除去粗盐中含有的Ca2+、Mg2+、SO42—及泥沙,可将粗食盐溶于水,然后进行下列操作:①过滤,②加稍过量的NaOH,③加适量盐酸,④加稍过量的Na2CO3溶液,⑤加稍过量的BaCl2溶液。正确的操作顺序为__________________。
23、A~H 八种物质相互反应或转化的关系如图,其中A为非金属固体单质,火药中含有A元素。C、E、F、G、H均为含A元素的化合物,F可转化为H,常温下D为液态,F、H为气态,透过蓝色的钴玻璃观察B的焰色反应呈紫色。![]()
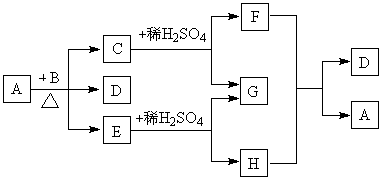
(1)A在周期表中的位置: 周期 族
(2)写出下列物质的电子式:
B D
(3)写出F和H反应的化学方程式
(4)写出下列反应的离子方程式
A + B:
H+Cl2(水):
24、下表是元素周期表的主族和零族部分,请用相应的化学用语回答有关问题:(用相应化学符号填写,下同)
| 主族 周期 | ⅢA | 0 | ||||||
| 1 | ||||||||
| 2 | A | B | ||||||
| C | D | E | ||||||
| F | G | H | ||||||
| 5 | J |
⑴A、B的气态氢化物的稳定性是 > 。
⑵A、B、C、D的离子半径由大到小的顺序
⑶若E的原子序数为m,则A的原子序数是 ,H的原子序数是 。
⑷C、D、F的最高价氧化物的水化物的碱性强弱顺序是 。
⑸E、G的最高价氧化物的水化物的酸性强弱顺序是 。
⑹C在空气中燃烧产物的电子式是 。
⑺A~J所有元素中,两两相互结合成原子个数比为1∶2的离子化合物的化学式是 。
25、向NaHSO4溶液中,逐滴加入Ba(OH)2溶液直至溶液呈中性,请写出反应的离子方程式______________________________________ ,在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式__________________________ 。
26、短周期元素x、y、z组成的化合物y2x和zx2,y2x溶于水形成的水溶液能与zx2反应生成一种化合物y2zx3。已知三种元素原子的电子总数为25,z和y的原子序数之和比x的原子序数的2倍还多1,z原子的最外层电子数是次外层电子数的2倍。试回答:
(1)x、y、z元素的名称:x___________ y___________ z____________
(2)写出zx2的化学式__________________________________。
(3)y2x对应水化物的电子式为____________ ,
其中存在的化学键___________ (填名称)
27、过氧化氢(H2O2)又称双氧水,它是一种二元弱酸,比碳酸的酸性还弱,且易 分解,但双氧水近年来很受人们青睐,并称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。请回答下列问题:
(1)写出H2O2的电子式 ,双氧水被称为绿色氧化剂的原因是 。
(2)下列物质不会使过碳酸钠失效的是 。
A.MnO2 B.H2S
C.CH3COOH D.NaHCO3
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,过氧化氢也有极弱的自偶电离,其自偶电离的电离方程式为: 。
(4)由于H2O2显弱酸性,在一定条件下它能同强碱作用生成正盐或酸式盐,请写出H2O2与Ba(OH)2反应生成正盐的化学方程式:
。
(5)久置的油画白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为: 。
(6)将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是弱酸,消耗了OH-而使红色褪去;乙同学则认为H2O2具有氧化性,将酚酞氧化而破坏其分子结构,使红色消失。请设计一个实验,检验甲、乙两位同学中谁的观点是正确的?
28、浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)反应后生成硫酸铜的物质的量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
29、在100ml含等物质的量的HBr和H2SO3的溶液里通入0.01molCl2,有一半Br—离子变为Br2(已知Br2能氧化H2SO3),求原溶液中H2SO3的物质的量浓度。
参考答案:
1、C 2、D 3、B 4、B 5、C 6、B 7、B 8、C 9、B 10、B
11、D、 12、C 13、C 14、C 15、A 16、B D 17、B 18、A D 19、D 20、A
21、(1)SO2、CO2,H2O(2)H2O,CO2、SO2(3)CO2、SO2,H2O
22、⑤②④①③或②⑤④①③
23、(1) 第3 周期 VIA 族
(2)B![]() D
D![]()
(3)2 H2S + SO2 = 3S + H2O
(4)3 S + 6 OH-= 2 S2-+ SO32-+ 3 H2O 、SO2 + Cl2 + 2 H2O = 4 H+ + SO42-+ 2 Cl-
24、⑴HF>NH3 ⑵N3->F->Na+>Mg2+
⑶m-9、m+19 ⑷KOH>NaOH>Mg(OH)2
⑸H2SO4>H3AsO4
⑹![]() ⑺Na2S、K2S、MgF2、MgBr2
⑺Na2S、K2S、MgF2、MgBr2
25、2H++SO42—+Ba2++2OH—=BaSO4↓+2H2O,Ba2++SO42—= BaSO4↓
26、(1)x 氧 y 钠 z 碳 (2) CO2 (3)Na+[ O H]—,离子键 极性键
27、(1) ![]() ,H2O2被还原的产物是无污染的H2O。
,H2O2被还原的产物是无污染的H2O。
(2)D。(3)![]() 。
。
(4)![]() 。
。
(5)![]() 。
。
(6)在红色褪去的溶液中滴加NaOH溶液,若出现红色,则甲的观点正确;若不出现红色,则乙的观点正确。
28、(1)0.1mol(2)0.2mol/L
29、0.067mol/L