高一第一学期期末调研考试化学试卷(A卷)
(可能用到的相对原子质量:H—1 O—16 CI—35. 5 S—32 Na—23 C—12
Zn—65 Mg—24 Al—27 K—39 Br—80 Fe—56 Cu—64)
第1卷 (选择题共45分)
一、选择题(每小题只有一个选项符合题意,3×15—45分)
1、下列化合物中阴离子和阳离子半经之比最大的是
A、LiI B、NaBr C、KCl D、CsF
2、下列物质保存方法正确的是 ( )
A、NaOH溶液常盛放在磨口玻璃塞的细口试剂瓶中
B、少量金属钠常存放在盛煤油的广口瓶中
C、氯水应放在无色细口瓶中
D、液溴应放在常胶塞的无色细口瓶中
3、在反应:KCIO3+6HCI=KCI+3CI2↑+3H2O中,当有8mol电子发生转移后,被
氧化与被还原的氯原子的物质的量比为
A、6:1 B、1:5 C、5:1 D、1:6
4、NA表示阿伏加德罗常数,下列叙述正确的是
A、在标准状况下,1mol任何气体单质均含有2NA个原子
B、lmolCl2发生化学反应,转移的电子数必定为2NA
C、在25℃,1.01×106Pa下,lmolHCl气体分子中含有18NA个质子
D、在标准状况下,22.4L甲烷和22.4L H2O的含电子数均为10NA
5、下列实验中没有白色沉淀或晶体析出的是
A、饱和的石灰水中加入少量的生石灰 B、饱和碳酸钠溶液中通人过量的CO2
C、氯化钙溶液中通人少量的CO2 D、硫酸氢钠溶液中加入BaCI2溶液
6、在无色透明的酸性溶液中,能大量共存的离子组是
A、Mg2+、![]() 、K+、Cl- B、K+、Ba2+、HCO
、K+、Cl- B、K+、Ba2+、HCO![]() 、NO
、NO![]()
C、Ca2+、NO![]() 、SO
、SO![]() 、F- D、MnO
、F- D、MnO![]() 、CI-、K+、Na+
、CI-、K+、Na+
7、下列反应的离子方程式正确的是
A、次氯酸钙溶液中通人过量的二氧化碳气体:
Ca2+2ClO-+H2O+CO2=CaCO3↓+2HClO
B、碳酸钙很醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C、小苏达溶液中加入过量的澄清石灰水:HCO![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
D、稀硫酸很氢氧化钡溶液:H++SO![]() +Ba2++OH-=BaSO 4↓+H2O
+Ba2++OH-=BaSO 4↓+H2O
8、下列物质的性质比较中,错误的是
A、熔沸点:F2<CI2<Br2<I2 B、颜色:F2、C12、Br2、12逐渐加深
C、还原性:HF>HCI>HBr>HI D、热稳定性:HF>HCI>HBr>HI
9、完全中和相同体积,相同物质的量浓度的氢氧化钠溶液,并生成正盐,需要相同体
积的盐酸、硫酸、磷酸的物质的量浓度比是
A、1:2:3 B、3:2:1 C、6:3:2 D、6:2:3
10、由两种金属组成的合金50g与氯气完全反应后,得到121g产物,则该合金的可能
组成是
A、Na、Zn B、Na、Al C、Fe、Mg D、Zn、Cu
11、下列溶液中C1-的物质的量浓度与500ml Imol/L的AICI3溶液中Cl-的物质的
量浓度相等的是
A、150ml lmol/L的NaCl溶液 B、75ml 2mol/LNH4C1溶液
C、150ml 3mol/L KCI溶液 D、500ml 3mol/L的FeCI 3溶液
12、下列实验能达到预期目的是
A、选用100ml量筒量取4.5ml稀硫酸
B、用托盘无平称量5.85g食盐固体
C、用烧碱溶液涂去CI2中混有的HCl气体
D、用加热方法分离I2和NaCl固体
13、下列各组中的两种物质相互作用时,当反应条件(温度、反应物用量比)改变,不会
引起产物的种类改变的是
A、Na和O2 B、Fe和盐酸 C、NaOH和C02 D、红磷和Cl2
14、由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同,则该混合气体
中CO2、H2和CO的体积比为
A、29:8:13 B、22:1:14 C、13:8:100 D、16:26:57
15、在甲、乙、丙三种溶液中各含有一种离子:CI-、Br-、I-向甲溶液中加入淀粉溶液
和氯水时,溶液变为橙色;再加入丙溶液,溶液颜色无明显变化。则乙溶液中含有的离子
A、Cl- B、Br- C、I- D、无法判断
第Ⅱ卷 (非选择题 共55分)
二、填空题。(本题包括3小题,共18分)
16、(6分)现有下列三个氧化还原反应。 ①2FeCl 3十2KI一2FeCl2+12+2KCI
②2FeCI2+C12—2FeCl3 ③2KMnO4+16HCl—2KCl+2MnCI 2+5C1 2+8H20在强酸
性溶液中,将MnO![]() 、Fe2+、Fe3+、I-和四种离子的溶液混在一起,充分反应后:
、Fe2+、Fe3+、I-和四种离子的溶液混在一起,充分反应后:
①若溶液中有l-剩余,则溶液中还可能有_______________,一定无____________;
②若Fe3+有剩余,则溶液中可能还有_________________,一定无_____________;
③若溶液中有Mn0![]() 剩余,则还可能有_________,一定无_______________。
剩余,则还可能有_________,一定无_______________。
17、(6分)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为
XY2(液)+3O2(气)=XO2(气)+2YO2(气),冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g·L-1。则:
①反应前在标准状况下O2的体积是——mL;
②化合物XY2的摩尔质量是____________;
③若XY2分子中X、Y两元素的质量比为3:16,则X、Y两元素的符号分别是______
和__________ 。
18、(6分)有A、B、C、D、E、F、G七种气体,它们分别是CO、O2、H2、C02、C12、HBr、HCl中的一种,通过下列事实回答问题:
①A、B、C均难溶于水,D、E能溶于水,F、G易溶于水;
②A和C都能在B中燃烧,火焰呈蓝色,且C在B中的燃烧产物是D;
③A也能在E中燃烧,火焰为苍白色,生成物为F。
据以上事实,生成下列反应的化学方程式:
(1)C在B中燃烧_______________________________________________;
(2)气体D通入足量澄清石灰水中__________________________________________;
(3)少量E气体通入足量G的水溶液中____________________________________________;
三、实验题(本题包括2小题,共23分)
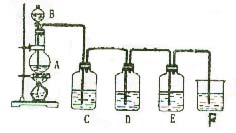 19、(14分)实验室用右图所示装置制备氯气,并
19、(14分)实验室用右图所示装置制备氯气,并
进行氯气性质实验,请回答下列问题:
(1)A中加入二氧化锰,B中盛有浓盐酸,则烧
瓶中发生反应的离子方程式为____________________________________________________;
(2)C中盛有紫色石蕊溶液,则C中的现象是__________________________________;
(3)D中盛有KI淀粉的混合溶液,现象是______________________________,反应化学方程式__________________________________;
(4)E中是AgNO3溶液,现象是______________________________________,反应化学方程式_____________________________,_____________________________。
(5)F中一般应盛有__________________________________溶液,其作用是_________________发生反应的离子方程式__________________________________。
20、(9分)现有溶质的质量分数为36.5%,密度为1.19g/cm3的盐酸,若配制2mol·L-1的盐酸250mL,需量取该浓盐酸____________ml。该实验所需要的仪器有_____________
____________、___________________、________________、___________、__________。
下列操作使配得溶液浓度偏高的是(填序号)_____________________ 。
A、洗净的容量瓶底部残留蒸馏水
B、把溶液从烧杯转移到容量瓶里时,不慎流到瓶外数滴
C、稀择浓盐酸的烧杯没有用蒸馏水
D、定容时俯视液面使之与刻度线相切
四、计算题(本题包括2小题,共14分)
21、(6分)钠、过氧化钠的混合物加入足量的水中生成的混合气体点火爆炸,恰好完
全反应,则原混合物中Na、Na2O2的物质的质量比是多少?
22、(8分)将一定量氯气通人250ml KBr溶液中,反应后将溶液蒸干,测知所得固体
中含溴元素10克,且K+和Cl-的物质的量之比为2:1,试求:
(1)标况下通人氯气的体积?
(2)原溴化钾溶液物质的量浓度?
高一化学参考答案及评分标准(A卷)
一、(注:每小题3分,共45分。)
四、
1.A 2. B 3.C 4.C 5.C 6.A 7.C 8.C 9.C 10.A
11 . C 12. D 13.B 14.C 15.C
16. (每空1分,共6分)
①Fe2+;MnO4和Fe3+: ②Mn04或Fe2+;l: ③Fe3+:Fe2+和I
17. (每小题2分,共6分)
①672 ②76g·moL ③C和S
I 8. (每空2分,共6分)
(1)2CO+O2 点燃 2CO2 (2)C02 +Ca(0H) 2 =CAC03 ↓+H2 0
(3)C12 +2H Br=2HCI+Br2
19. (共14分)
(I)MnO2 +4H++2Cl △ Mn2++2H2O+C12 ↑ (2分)
(2) 先变红,后褪色 (2分)
(3) 变蓝 (1分) C12+2KI=2KCI+12 (2分)
(4) 白色沉淀 (1分) C12+H2O=HCI+HCIO HCI+AgNO3=AgCI ↓+HNO3 (各1分)
(5) NaOH (1分) 吸收剩余C12,以防污染空气 (1分)
C12+2NaOH=NaCI+NaCIO+H20 (2分)
20. (共9分)
① 42.0 (2分) ②量筒、烧杯、胶头滴管、玻璃棒、250mL容量瓶 (各1分)
③ D (2分)
2 1. 由2Na+2H2O=2NaOH+H2 ↑
2Na2O2+2H2O=4NaOH+O2↑
2H2+O2 点燃 2H2O
得关系式:2Na~Na2O2 (3分)
故:原混合物中Na与Na2O2的物质的量比为2:1 (1分)
则:原混合物中Na与Na2O2质量比为:![]() =23:39 (2分)
=23:39 (2分)
22.由题意知:
反应后残留固体中含Br-为:![]() 0. 125moL
0. 125moL
即剩余的KBr为0. 125moL (2分)
再由电荷守恒及nK+=2nCI-知:
生成的KCI与未反应的KBr的物质的量相等,即为0. 125moL (2分)
设消耗标况下,C12为xL,消耗KBr为ymoL
由C12+2KBr=2KCI+Br2
22.4L 2moL 2moL
xL ymoL 0. 125moL
得:![]() ∴x=1.4L (2分)
∴x=1.4L (2分)
![]() ∴y=0.
125moL
∴y=0.
125moL
则原KBr的物质的量浓度为:![]() =l moL/L (2分)
=l moL/L (2分)
注:解题的方法任选,只要思路合理,结果正确,均可得分。
高一化学(A卷)