![]()
|
|
学科: 化学 |
| 教学内容:气体摩尔体积 |
【基础知识精讲】
一、决定物体体积的因素有三:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间的距离的大小.
相同条件下,相同物质的量的不同物质,固体液体的体积主要取决于物质粒子本身的大小,而对于气体的体积则主要取决于粒子之间距离的大小,当温度和压强一定时,气体分子间的平均距离大小几乎是一个定值.
二、气体的摩尔体积
①标准状况 即0℃1个大气压(101KPa)
②1mol任何气体 纯净或混合物均匀且其物质的量总和应为1mol
③体积约为22.4L
4.概念:单位物质的量气体所占的体积叫气体摩尔体.Vm=![]() ,单位为L/mol和m3/mol.
,单位为L/mol和m3/mol.
三、阿伏加德罗定律
相同温度和压强下,相同体积的任何气体都含有相同数目的分子.
对该定律既要从影响气体物质体积的因素出发定性分析和理解,要能灵活运用理想气体状态方程.
①![]() =
=![]() ②PV=nRT=
②PV=nRT=![]() RT(R为常数).
RT(R为常数).
阿伏加德罗定律的推论:(n:物质的量;ρ:气体的密度;M:气体的摩尔质量;V:气体的体积;m:气体的质量;N:气体的分子数.)
(1)同温、同压下:![]() =
=![]() =
=![]()
(2)同温、同体积下:![]() =
=![]() =
=![]() ,
,
(3)同温、同压下:![]() =
=![]()
(4)同温、同压、同体积下:![]() =
=![]()
(5)同温、同压、同质量下:![]() =
=![]()
(6)同温、同体积、同质量下:![]() =
=![]()
四、求气体的相对分子质量(或平均相对分子质量)
(1)已知标准状况时气体密度ρ,M1=22.4ρ.
(2)已知非标准状况气体温度、压强、密度,M1=![]() .
.
(3)已知两种气体的相对密度D,MA=DMB.
气体的相对密度:D=![]() =
=![]() .
.
(4)混合气体的平均式量(n1,n2,…表示混合物中各组分的物质的量;V1,V2,…表示混合物中各组分的体积;M1,M2,…表示混合物中各组分的式量):混合气体本来无式量,但对组成一定的混合气体来说,可以根据其各组的组成和式量来计算所谓的平均式量.它在数值上等于混合气体的平均摩尔质量,其表达式为:
![]() =
=![]() =
=![]()
=M1·n1%+M2·n2%+…+Mi…ni%
=![]()
=M1·V1%+M2·V2%+…+MiVi%
混合物的式量可以用平均值法确定.如空气的主要成分为O2和N2,空气的平均相对分子质量为29,介于两种气体相对分子质量之间.
【重点难点解析】
1.物质的体积与组成物质粒子的关系:
(1)总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体.②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等.
(2)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小.
(3)决定气体体积大小的因素:气体分子间平均距离比分子直径大得多,因此,当气体的物质的量(粒子数)一定时,决定气体体积大小的主要因素是粒子间平均距离的大小.
(4)影响气体分子间平均距离大小的因素:温度和压强.温度越高,体积越大;压强越大,体积越小.当温度和压强一定时,气体分子间的平均距离大小几乎是一个定值,故粒子数一定时,其体积是一定值.
2.对“在标准状况下,1mol任何气体所占的体积都约是22.4L”的理解:
(1)标准状况:指0℃、1.01×105Pa的状态.温度越高,体积越大;压强越大,体积越小.故在非标准状况下,其值不一定就是“22.4L”.
(2)1mol气体在非标准状况下,其体积可能为22.4L,也可能不为22.4L.
(3)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离.在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下气体摩尔体积都约是22.4L/mol.
(4)此概念应注意:①气态物质;②物质的量为1mol;③气体状态为0℃和1.01×105Pa(标准状况);④22.4L体积是近似值;⑤Vm的单位为L/mol和m3/mol.
(5)适用对象:纯净气体与混合气体均可.
例1 下列说法正确的是( )
A.32gO2占有的体积约为22.4L
B.22.4LN2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4L水的质量约为18g
D.22g二氧化碳与标准状况下11.2LHCl含有相同的分子数
解析:本题考查的是对气体摩尔体积概念理解的准确性.A、B都没有“标准状况”是错误的;C是有标准状况条件,但在此条件下水是液体,所以22.4L水不是1mol,也不是18g;D项中22gCO2物质的量为0.5mol,标准状况下11.2LHCl物质的量也为0.5mol,两种气体的物质的量相同,所以含有的分子数也相同,因此D选项符合题意.
答案:D.
例2 两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温、同压下,两容器内的气体一定具有相同的( )
A.原子总数 B.质子总数
C.分子总数 D.质量
解析:由气体定律可知,在同温、同压下,同体积的任何气体含有相同的分子数,故两容器内分子总数相等.由于3种气体各自都是双原子分子,故原子总数一定相等.又由于N和O原子的质子数和摩尔质量不同,则质子总数和质量不一定相等.
答案:AC.
例3 同温、同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是( )
A.密度比为16∶11 B.密度比为11∶16
C.体积比为1∶1 D.体积比为11∶16
解析:等质量的SO2与CO2的体积比等于其物质的量之比:![]() :
:![]() ,即为相对分子质量的反比:44∶64=11∶16,密度比为相对分子量之比:64∶44=16∶11
,即为相对分子质量的反比:44∶64=11∶16,密度比为相对分子量之比:64∶44=16∶11
答案:AD
【难题巧解点拨】
例1 二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2.今用0.228gCS2在448mL氧气(标准状况)中完全燃烧,反应后气体混合物在标准状况时的体积是( )
A.112mL B.224ml C.336mL D.448mL
分析 体积守恒法.根据反应:CS2(液)+3O2(气)=CO2(气)+2SO2(气)
可知反应中消耗O2的体积等于生成的CO2和SO2的体积.因标准状况下CS2为液体,所以不管O2是否过量,也不管反应进行到什么程度,反应过程中气体的体积始终不变,故选D.
例2 在标况下,下列各组气体混合其平均相对分子量可达到40的是( )
A.N2和O2 B.CO2和O2 C.SO2和CO2 D.HI和HCl
分析 中介法(平均值法).Mr(CO2)>40 Mr(N2)<40 Mr(O2)<40 Mr(SO2)>40 Mr(HI)>40 Mr(HCl)<40
只有一个比40大一个比40小才满足要求,故选B、D.
例3 某物质A在一定条件下加热分解,产物都是气体.分解方程式为2A![]() B+2C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
B+2C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A.7d B.5d C.5d D.2d
分析 根据题给出的方程式知,完全分解后生成气体的平均摩尔质量![]() =[M(B)+2M(C)+2M(D)]/5.根据题意
=[M(B)+2M(C)+2M(D)]/5.根据题意![]() =d·M(H2)=d·2g/mol,则M(B)+2M(C)+2M(D)=5
=d·M(H2)=d·2g/mol,则M(B)+2M(C)+2M(D)=5![]() =10dg/mol.
=10dg/mol.
又根据质量守恒定律:
2mol·M(A)=1mol·M(B)+2mol·M(C)+2mol·M(D),
所以M(A)=5dg/mol,Mr(A)=5d.选(B).
评注 本题运用了相对密度、平均相对分子质量、质量守恒定律等知识进行综合判断.
例4 将1.5g两种金属的混合物粉末与足量的稀盐酸反应,反应完全后,得到标准状况下的氢气1.12L,则两种金属可能是( ).(“三南”高考题)
A.Mg和Cu B.Zn和Cu C.Al和Fe D.Mg和Al
分析 先电荷守恒法(得失电子数相等):金属单质失去的电子被盐酸中的H+得到后变成H2,n(H2)=0.05mol,得到0.1mole-.再利用扩大法:H+得电子数变为1mol时混合金属应为15g.再利用极值法:每一金属失去1mole-各需质量是Mg:12g Zn:32.5g Al:9g Fe:28g Cu不与盐酸反应可认为>15g.最后用平均值法:A、C符合
【课本难题解答】
P55 四、3(1)同温同压下,![]() =
=![]() ,由于V1=V2,故n(N2)=n(O2),n(N2)=n(O2)=1∶1,N(N2)∶N(O2)=1∶1
,由于V1=V2,故n(N2)=n(O2),n(N2)=n(O2)=1∶1,N(N2)∶N(O2)=1∶1
(2)![]() =
=![]() =
=![]() =7∶8
=7∶8
【典型热点考题】
例1 同温同压下,某瓶充满O2重116g,充满CO2时重122g,充满某气体共重114g,则该气体相对分子质量为( )
A.28 B.60 C.32 D.14
解析:本题应用的是气体体积和物质的量相互之间的关系.由于瓶的体积是固定的,所以O2、CO2和某气体体积相等,即物质的量相等.列出关系式,即可求解.
设瓶重为m(瓶),则![]() =
=![]() 解得m(瓶)=100g,三种气体的物质的量均为:m=
解得m(瓶)=100g,三种气体的物质的量均为:m=![]() =0.5mol,故M(气体)=
=0.5mol,故M(气体)=![]() =28g·mol-1.
=28g·mol-1.
答案:A
例2 体积为1L的干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082.将此气体倒扣在水中,进入容器中液体的体积是( )
A.0.25L B.0.5L C.0.75L D.1L
解析:![]() =D·Mr(O2)=1.082×32=34.6<Mr(HCl)=36.5,故该混合气体中必混有空气.HCl易溶于水,空气不溶于水,故进入容器中液体的体积等于HCl气体的体积.设HCl气体的体积为x,则空气的体积为(1L-x).
=D·Mr(O2)=1.082×32=34.6<Mr(HCl)=36.5,故该混合气体中必混有空气.HCl易溶于水,空气不溶于水,故进入容器中液体的体积等于HCl气体的体积.设HCl气体的体积为x,则空气的体积为(1L-x).
根据气体平均摩尔质量计算公式:
36.5g/mol·x/1l+29g/mol·(1L-x)/1L=34.6g/mol,
解得 x=0.75L
故答案为C.
答案:C
例3 有Mg、Al、Fe、Cu四种金属,若两两混合,取混合物26g与足量稀硫酸反应,产生标准状况下H211.2L,此混合物的可能组合的方式最多有( )
A.2种 B.3种 C.4种 D.5种
解析:本题不能根据化学方程式,采用排列组合的方法,设未知数讨论求解,这样运算量太大,且极易出错.此类题可用“平均摩尔电子质量法”巧解.
所谓“摩尔电子质量”是指物质得失1mol电子所需要的质量,常用Me-表示,单位为g/mole-.
n(H2)=![]() =
=![]() =0.5mol
=0.5mol
因为2H++2e-→H2↑,所以共得0.5mol×2=1mole-,则金属混合物必失去1mole-,故:
Me-=![]() =26g/mole-
=26g/mole-
又Me-(Mg)=![]() =12g/mole-
=12g/mole-
Me-(Al)=![]() =9g/mole-
=9g/mole-
Me-(Fe)=![]() =28g/mole-
=28g/mole-
Cu与稀H2SO4不反应,视为Me-(Cu)无限大.
根据平均值原理,混合物可能组合的方式有:Mg、Fe;Al、Fe;Mg、Cu;Al、Cu.共四种.
答案:C
例4 如果ag某气体中含有的分子数为b,则cg该气体在标准状况下体积(式中NA为阿伏加德罗常数)( )
A. ![]() L B.
L B.
![]() L C.
L C.
![]() L D.
L D. ![]() L
L
解析:由题知一个分子质量为![]() ,而1mol气体的质量即摩尔质量为
,而1mol气体的质量即摩尔质量为![]() ·NA,cg该气体的物质量的量为c÷(
·NA,cg该气体的物质量的量为c÷(![]() ·NA),体积为
·NA),体积为![]() ,故选A.
,故选A.
答案:A
例5 下列说法正确的是( )
A.1mol任何气体的体积都约是22.4L
B.20℃,1.0×105Pa,同体积的O2,CO2含有相同的分子数
C.1mol气态物质,当体积为22.4L时,该气体一定处于标准状况
D.2mol气体体积约为44.8L
解析:A中缺少标准状况的条件;B根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同的数目的分子,故B正确;C中,1mol气态物质在非标准状况时,体积也有可能等于22.4L;D中缺少标准状况条件.故选B.
答案:B
例6 氢气和氧气的混合气体,在120℃和一定压强下体积为a升,点燃后发生反应.待恢复至原来温度和压强时,测得其体积为b升.原混合气体中氢气和氧气的体积各是多少升?
解析:这是根据阿伏加德罗定律进行讨论计算型能力考查题,比较快速的解法是“差量法”.
设参加反应的H2为x升,O2为y升.
2H2+O2 = 2H2O(气) ΔV
2 1 2 1
x y a-b
x=2(a-b)L y=(a-b)L
讨论:(1)当H2与O2恰好完全反应时
![]() =2(a-b)L
=2(a-b)L ![]() =(a-b)L
=(a-b)L
或![]() =
=![]() aL或
aL或![]() =bL
=bL
![]() =
=![]() aL或
aL或![]() =
=![]() bL
bL
(2)当H2过量时,O2全部参加反应
![]() =(a-b)L
=(a-b)L
![]() =a-(a-b)=b(L)
=a-(a-b)=b(L)
(3)当O2过量时,H2全部参加反应
![]() =2(a-b)L
=2(a-b)L
![]() =a-2(a-b)=(2b-a)L
=a-2(a-b)=(2b-a)L

【同步达纲练习】
一、选择题
1.在标准状况下,下列气体体积最大的是( )
A.32gO2 B.3gH2 C.30gH2S D.14gN2
2.2gH2的体积为( )
A.22.4L B.11.2L C.44.8L D.不确定
3.下列说法正确的是( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1molNe含有的原子数为NA
C.71gCl2所含原子数为NA
D.在同温同压下相同体积的任何气体质量所含原子数相同
4.如果ag某气体中含有分子数为b,则cg该气体在标准状况下的体积是( )
A. ![]() L B.
L B. ![]() L C.
L C.
![]() L D.
L D.
![]() L
L
5.在同温同压下质量相同的X、Y两气体,已知此时V(Y)>V(X),则Mr(Y)和Mr(X)的关系是( )
A.Mr(X)>Mr(Y) B.Mr(X)<Mr(Y)
C.Mr(X)=Mr(Y) D.无法确定
6.在给定温度和压强下影响气体所占体积大小的主要因素是( )
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
7.1molO2在放电情况下,有30%转化为臭氧(O3),则放电后所得混合气体对H2的相对密度是( )
A.16 B.17.8 C.18.4 D.35.6
8.下列说法正确的是( )
A.CO2和O2的摩尔体积都约是22.4升
B.总质量为28克的CO和乙稀C2H4的混合气体,体积是22.4升
C.18克水和100℃时的22.4升水蒸汽的质量相等
D.3.01×1023个CH4分子和40克SO3分子数相等而体积不一定相等
9.质量都为4.2克的A气体和B气体,在标准状况下的体积分别为3.36升和2.94升,则这两种气体的分子量之比为( )
A.1∶1 B.15∶13 C.7∶8 D.8∶7
10.在150℃时加热高氯酸铵分解2NH4ClO4![]() N2+Cl2+2O2+4H2O其气态物组成的混合气体的平均分子质量是( )
N2+Cl2+2O2+4H2O其气态物组成的混合气体的平均分子质量是( )
A.40.75 B.29.375 C.14.69 D.无法计算
二、填空题
11.标准状况下,5.6L某气体的质量为11g,其摩尔质量是 ,相对分子质量是 .
12.成人每分钟大约吸入8LO2(标况),则每天(24小时)吸入的O2相当 mol,质量为 g.
13.已知NH4CO3![]() NH3↑+H2O↑+CO2↑在150℃时NH4CO3分解产生的混合气体A的密度是相同条件下H2密度的 倍.
NH3↑+H2O↑+CO2↑在150℃时NH4CO3分解产生的混合气体A的密度是相同条件下H2密度的 倍.
三、计算题
14.某O2和H2混合气体对氢气的相对密度为4.75(同状态),此混合气体中O2和H2的质量之比是多少?
【素质优化训练】
一、选择题
1.标准状况下,0.5molA2与33.6LB2气体完全化合生成1molC物质,则C的化学式为( )
A.A2B B.AB C.AB2 D.AB3
2.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( )
A.密度之比为16∶11 B.密度之比为11∶16
C.体积之比为1∶1 D.体积之比为11∶16
3.假设12C原子量为24,如果以0.024kg12C所含的原子数为阿伏加德罗常数,下列数值肯定不变的是( )
A.气体摩尔体积 B.标准状况下,16gO2所占体积
C.O2的分子量 D.某条件下,跟2gH2相化合的O2的物质的量
4.在标况下CO和CO2混合气体的体积为5.6L,若CO的质量为5.6g,则CO2的质量为( )
A.5.6g B.4.4g C.2.2g D.1g
5.1molCl2和36.5gHCl气体的体积,前者与后者的关系是( )
A.大于 B.小于 C.等于 D.不能确定
6.在同温同压下,A容器的H2和B容器的NH3,若所含原子总数相等,则这两个容器的体积比是( )
A.2∶1 B.1∶2 C.2∶3 D.1∶3
7.在标准状况下,某气体的密度为1.25g/L,该气体的摩尔质量为( )
A.12.5g/mol B.14g/mol C.28g/mol D.30g/mol
8.下列各组中两种气体的分子数一定相等的是( )
A.同质量、同体积的O2和N2 B.同质量、密度不等的N2和C2H4
C.同体积、同密度的CO和C2H4 D.同压、同体积的N2和O2
二、填空题
9.同温同压下,同体积的氢气和气体A的质量分别是0.2g和3.4g,则气体A的式量为
,A的分子数为 .
10.用MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O制氯气,当有4molHCl被氧化时,生成氯气的体积在标准状况下是 L.
MnCl2+Cl2+2H2O制氯气,当有4molHCl被氧化时,生成氯气的体积在标准状况下是 L.
11.常温下A和B两种气体组成的混合气体(A的式量小于B的式量),经分析混合气体只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于14/3.由此可确定A为 ,B为________,其理由是 .若上述混合气体中氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为 ,A在混合气体中的体积分数为 .
12.相同状况下,同体积的O2与SO2气体的质量比是 ,同质量的O2和SO2气体在相同状况下,体积之比是 .
三、计算题
13.学生甲称取一定量的KClO3,加入少量MnO2混合后在试管中加热,当他收得所需的O2后,停止加热并冷却.学生乙测知甲收集到O2的体积,他先称出甲实验后的固体质量为9.80g,继续加热至KClO3完全分解,得O21.613L(标况)最后他将加热后的固体投入足量水中,经过溶解,过滤、干燥后,称得不溶物的质量为1.54g.写出有关化学方程式,并计算学生甲在标况下收集到O2的体积.
【生活实际运用】
医院在抢救病危患者时常常要给病急患者输送氧气,为了携带方便,常常使用氧气包.若氧气包的氧气在常压下输出速率为10mL/S,现有一人在距医院有10分钟路程的地方发生车祸,问医护人员带上一个压强为3个大气压、容积为15L的氧气包是否够用?
解析:氧气包是否够用,实际上就是看其是否能维持10分钟的输出时间.先将3个大气压下的氧气转化为常压下的氧气,求出其体积.根据理想气体状态方程:P1V1=P2V2,V2=![]() .
.
V2=![]() =45L=4.5×104mL
=45L=4.5×104mL
维持输出时间为:t=![]() =4.5×103S=75分钟>10分钟
=4.5×103S=75分钟>10分钟
所以带一个氧气包够用.
【知识探究学习】
向某二价金属M的氢氧化物的澄清溶液100mL中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中,在标准状况下收集到4.48L气体.将滤液加水稀释至250mL,取出25.0mL恰好与20.0mL盐酸完全反应并收集到1.12L(标准状况下)气体.
(1)若欲计算M的相对原子质量,你认为还必须提供下列哪组数据(填代号)( )
A.M的氢氧化物溶液的浓度(设为2.00mol·L-1)
B.MCO3沉淀的质量(设为39.4g)
C.与MCO3反应的盐酸的浓度(设为1.00mol·L-1)
D.题设条件充足,不需补充数据
(2)根据你的选择,求算M的相对原子质量和加入的NaHCO3溶液中含NaHCO3的质量.
解析:(1)本题涉及的反应有:
M(OH)2+2NaHCO3 = MCO3↓+Na2CO3+2H2O
MCO3+2HCl = MCl2+H2O+CO2↑
现已知n(CO2)=![]() =
=![]() =0.2mol
=0.2mol
因n(MCO3)=n(CO2)=0.2mol,所以只要知道B,即可求得MCO3的摩尔质量,进而计算出M的相对原子质量.
(2)M(MCO3)=![]() =
=![]() =197g/mol
=197g/mol
Mr(M)=197-(12+16×3)=137(Ba)
滤液中含有生成的Na2CO3和过量的NaHCO3,与盐酸反应后生成的气体仍为CO2:![]() ×
×![]() =0.5mol.
=0.5mol.
图示如下:
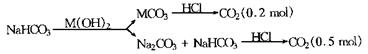
由碳元素守恒得:n(NaHCO3)=0.2mol+0.5mol=0.7mol.
所以m(NaHCO3)=0.7mol×84g/mol=58.8g.
答:略

参考答案:
【同步达纲练习】
一、1.B 2.D 3.B 4.A 5.A 6.D 7.B 8.D 9.C 10.B
二、11.44g·mol-1;44 12.514.3;16457.1 13.13 14.16∶3
【素质优化训练】
一、1.D 2.AD 3.B 4.C 5.D 6.A 7.C 8.BC
二、9.34;H2S
10.44.8L 11.A为NH3 B为N2;NH3中氮和氢的质量比等于![]() ;4∶1;80%
12.1∶2;2∶1
;4∶1;80%
12.1∶2;2∶1
三、13.V(O2)=1.07L 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
