高中化学同步练习第一册
第七章 碳族元素 无机非金属材料
综合练习试题(四) (命题人:邱常清)
姓名________ 班级________ 学号________
一、选择题(本题包括8小题,每小题1分,共8分。每小题只有一个选项符合题意。)
1.碳的化合物多为共价化合物的原因是 ( )
A.碳属于非金属元素 B.碳原子最外层有4个电子
C.碳具有较强的还原性 D.碳有多种同素异形体
2.在自然界中,不呈游离态存在的元素有 ( )
A.硫 B.碳
C.硅 D.氮
3.金刚石与石墨或晶体硅与无定形硅互为 ( )
A.同位素 B.同素异形体
C.同一种核素 D.同一种单质
4.下列物质直接由原子构成,且又属于酸酐的是 ( )
A.SiO2 B.CO2
C.晶体硅 D.C60
5.下列物质中直接由分子构成的是 ( )
A.过氧化钠 B.石英
C.硅酸钙 D.干冰
6.二氧化碳是 ( )
A.由非极性键形成的非极性分子
B.由极性键形成的极性分子
C.由极性键形成的非极性分子
D.其固态时叫干冰,干冰是直接由原子构成的
7.二氧化碳气体中含有少量氯化氢,除去氯化氢最好选择 ( )
A.饱和NaHCO3溶液 B.饱和石灰水
C.饱和Na2CO3溶液 D.烧碱溶液
8.下列氢化物的稳定性由强到弱的顺序排列的是 ( )
A.BH3、CH4、NH3、H2O
B.H2O、NH3、CH4、SiH4
C.SiH4、GeH4、CH4、H2Se
D.H2Te、H2Se、H2S、H2O
二、选择题(本题包括10小题,每小题2分,共20分。每小题一个或两个选项符合题意若正确答案只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分)
9.下列溶液久置空气中,不产生浑浊现象的是 ( )
A.水玻璃 B.氢硫酸
C.Na2SO3溶液 D.火碱溶液
10.下列情况下,两种物质不发生反应的是 ( )
A.二氧化硅放入浓硫酸中
B.二氧化硅与纯碱混合加热
C.二氧化硅与碳在高温下混合
D.二氧化硅放入氢氟酸溶液中
11.下列各组酸中,酸性前者比后者弱的是 ( )
A.H4SiO4与H2CO3 B.HclO4与H2SO4
C.HClO与H2CO3 D.HI与HF
12.下列说法中,不正确的是 ( )
A.二氧化硅溶于水形成硅酸,所以SiO2是酸酐
B.因为高温时二氧化硅与纯碱反应放出二氧化碳,所以硅酸的酸性比碳酸强
C.虽然二氧化硅是酸性氧化物,但它能跟氢氟酸发生反应
D.将CO2气体通入水玻璃可以得到原硅酸(H4SiO4)
13.将空气与二氧化碳按5 :1 体积比混合,跟足量的赤热焦碳充分反应,若反应前后的温度相同,则在所气体中,一氧化碳的体积分数为(假定空气中氮气、氧气的体积比为4 :1 ,其他成分忽略不计) ( )
A.29% B.43%
C.50% D.100%
14.近年来,科学家又发现了一些以新的单质形态存在的碳,其中比较重要的是1985年发现的C60,它具有空心的类似足球状结构,由于C60分子的结构酷似足球,所以被称为足球稀(Footballene)。有关它的下列说法中正确的是 ( )
A.C60中含有离子键
B.C60中只含有非极性共价键
C.C60的摩尔质量为720
D.C60与金刚石、石墨都是碳的同素异形体
15.将1体积选项中的一种气体与10体积O2混合后,依次通过盛有足量浓NaOH溶液的洗气瓶和盛有足量灼热铜屑的硬质玻璃管(假设每步反应都进行得完全),最后的尾气可能是 ( )
A.Cl2 B.CO
C.CO2 D.N2
16.下列盐溶液中加入BaCl2溶液生成白色沉淀,再加入稀硝酸振荡,白色沉淀不消失的是 ( )
A.Na2SO3 B.K2CO3
C.K3PO4 D.Na2SiO3
17.欲除去CO2中含有的少量SO2杂质,可以从:①NaOH溶液;②NaHCO3溶液;③Na2SO3溶液; ④硝酸酸化的Ba(NO3)2溶液; ⑤NaHSO3溶液;⑥酸性KMnO4溶液中选择试剂。可选择的试剂有 ( )
A.只有② B.②和④
C.②、⑤和⑥ D.②、③、④和⑥
18.对CO2和SiO2来说,正确的是 ( )
A.都是直接由分子构成的
B.原子之间的化学键类型相同
C.物理性质基本一致
D.都是酸性氧化物一均与碱反应生成盐和水
三、填空题(本题包括2小题,共20分)
19.(11分)短周期元素A、B、C、D,原子半径依次增大,A、B在同一周期,B、C在同一主族,C元素原子核外电子数等于A、B元素原子核外电子数之和;C元素原子最外层电子数是D元素原子最外层电子数的4倍。请简答:
(1)B、C两元素的元素符号是:B__________,C________。
(2)这四种元素的单质熔点由高到低的顺序是____________________________。
(3)元素A和D按原子个数比为1 :1 ,形成的化合物的电子式为_______________;该物质为_________(填化合物类型),其化学键既有_________键,又有_______ 键。又知该化合物能跟A、B组成的某种化合物反应,生成A的单质,写出该反应的化学方程式:_____________________________________。
(4)A、B、D组成的一种常见化合物与A、C组成的常见化合物在一定条件下反应的化学方程式是:__________________________________________________。
20.(9分)有A、B、C、D四种含有硅元素的物质,它们能发生如下变化:
①A溶液与钙盐溶液反应生成白色沉淀D;
②B在空气中燃烧生成C;
③C与烧碱反应生成A和水;C在高温下与CaCO3反应生成D和一种气体;C在高温下与碳反应生成单质B。
根据上述变化,简答下列问题:
(1)写出A、B、C、D的化学式:_________、__________、__________、___________。
(2)写出反应①的离子方程式:__________________________________________。
(3)③中的变化如有氧化还原反应,请写出该反应的化学方程式,并标出电子转移方向和数目:
_____________________________________________________________________。
四、推断简答题(本题包括2小题,共19分)
21. (11分)A是(中学化学中)常见固体。在加热条件下,A可与一种无色溶液B反应,生成气体混合物X(a和b),进行如下框图所示的实验:
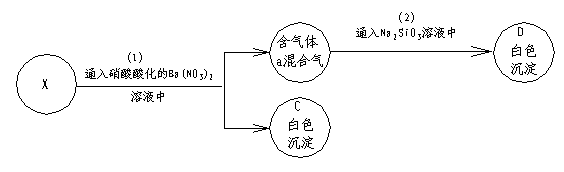
试推断:A是________;B是__________;C是___________;D是__________;X是_________。然后写出A和B反应的化学方程式:_________________________________;分别写出步骤(1)、(2)反应的离子方程式____________________________;_______________________。
22.(8分)A、B、C、D均为二元化合物,甲、乙、丙是三种单质。这些常见的化合物与单质之间的关系如框图所示(又知C为最简单的有机物)。
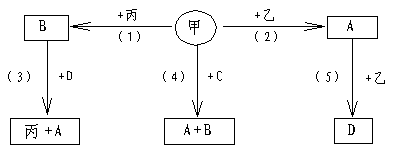
试推断写出化合物A、B、C的电子式及单质甲的分子式:A_____________;B:___________;C___________________;甲___________。
五、实验题(本题包括2小题,共16分)
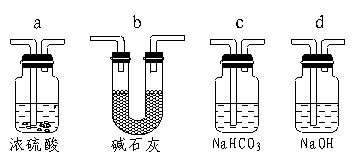
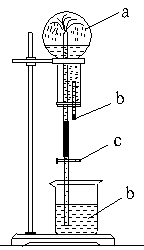 |
23题图
23.(6分)将图(23题图)所示装置中,烧瓶内充满干燥气体a,将胶滴管内液体b挤入烧瓶内,轻轻振荡烧瓶,然后将水止夹C打开,烧杯内液体b呈喷泉状喷出,烧瓶中形成白色浑浊液体,最终几乎充满烧瓶。则a、b不可能是__________(填所选选项的序号);请分析其理由(要求写化学方程式简析原因)。
__________________________________________________________。
A.CO2(g)、Ba(OH)2溶液
B.SO2(g)、HNO3和Ba(NO3)2溶液
C.SO2(g)、Ba(OH)2溶液
D.HCl(g)、AgNO3溶液
24.(10分)利用图[24题图(a)]所示实验装置进行实验可以研究CO的还原性。
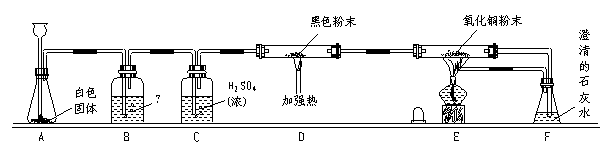
24题图(a)
请填写下列空白:
(1) 从A的长颈漏斗应加入的试剂是____________(填序号)
A.稀硫酸 B.浓硫酸 C.稀盐酸 D.浓硝酸
(2)装置B中最适宜的试剂是_________________。
(3)装置D中发生反应的化学方程式是_________________
(4)装置E中发生的现象是__________________________________。
(5)必须用装置C吸收除去气体中水蒸气的理由主要是_____________________________。(6)若根据F中澄清石灰水变浑浊的现象也能确认CO具有还原性,则应在原图所示装置____________与___________之间连接上所示图[24题图(b)]的哪一种装置__________(填写序号)。目的是____________________;
 |
24题图(b)
(7)由F装置排出的尾气需要点燃的原因是__________________________________。
六、计算题(本题包括2小题,共17分)
25.(7分)有两瓶溶液,A溶液:1Lmol•L—1的纯碱溶液;B溶液:1L1.25mol•L—1的盐酸。试计算在下列两种情况下产生的CO2在标准状况下的体积是多少升?(忽略CO2溶解于水)
?
(1)将A逐滴加入到B中;
(2)将B逐滴加入到A中;
26.(10分)在已平衡的托盘天平两边各放一只等质量的烧杯,并分别注入5mol•L—1的盐酸60Ml。向在盘烧杯中放入agCaCO3粉末,向右盘烧杯中加入xgA物质粉末,反应后仍然平衡。
(1)若A为NaHCO3①当a≤15时,x=_____;②当18.6≥a>15时,x=_______;③当a>18.6时,x=_______(一律用含a的代数式表示x的值)。
(2)若A为KHCO3,且两只烧杯中均无固体物质存在,x值须满足的条件是_________。
综合练习试题(四) 参考答案
一、
1.B 2.C 3.B 4.A 5.D 6.C 7.A 8.B
二、
9.C、D 10.A 11.A、C 12.A、B 13.A、 14.B、D
15.C、D 16.A、D 17.D 18.B、D
三、
19.(1)B :6C; C :14Si (2)C>Si>Na>O2
![]() (3) Na+ Na+
;离子化合物,离子键,非极性键。
(3) Na+ Na+
;离子化合物,离子键,非极性键。
![]() 2Na2O2+CO2 ====2Na2CO3+O2
2Na2O2+CO2 ====2Na2CO3+O2
(4)Na2CO3+SiO2 Na2SiO3+CO2↑
20.(1)Na2SiO3、Si、SiO2、CaSiO3
(2)SiO![]() +Ca2+==CaSiO3↓
+Ca2+==CaSiO3↓
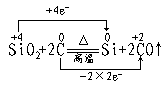 |
(3)
四、
21.A:C(碳);B:H2SO4浓;C:BaSO4;D:H2SiO3;X:CO2(a)、SO2(b)。
A与B反应:C+2H2SO4 2H2O+2SO2+CO2
(1)3SO2+2H2O+3Ba2++2NO![]() ===3BaSO4↓+4H++2NO↑
===3BaSO4↓+4H++2NO↑
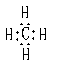 (2)CO2+SiO
(2)CO2+SiO![]() +H2O===H2SiO3↓+CO
+H2O===H2SiO3↓+CO![]()
![]()
![]() 22.A:
B:
C:
甲:O2。
22.A:
B:
C:
甲:O2。
![]()
提示:高温时水是氧化剂(3)H2O+CO H2+CO2
五、
![]() 23.B;SO2与HNO3,Ba(NO3)2混合溶液作用时,除生成白色沉淀BaSO4外,还生成NO气体,则液体不可能几乎充满烧瓶。反应为:3SO2+2H2O+3Ba(NO3)2===3BaSO4↓+4HNO3+2NO↑。
23.B;SO2与HNO3,Ba(NO3)2混合溶液作用时,除生成白色沉淀BaSO4外,还生成NO气体,则液体不可能几乎充满烧瓶。反应为:3SO2+2H2O+3Ba(NO3)2===3BaSO4↓+4HNO3+2NO↑。
24.(1)C。 (2)饱和NaHCO3溶液。 (3)CO2+C 2CO。
![]() (4)黑色的CuO粉末逐渐变成亮红色。
(4)黑色的CuO粉末逐渐变成亮红色。
(5)若不除去水蒸气,则可能发生H2O(g)+C(s) CO(g)+H2(g),而H2 也可以还原CuO。 (6)DE,b或d。除去混在CO中的CO2气体。 (7)防止尾气中CO污染环境。
六、
25.解:
由于,A为1 mol•L—1Na2CO3,n(Na2CO3)=1mol
B为1L1.25 mol•L—1的HCl,n(HCl)=1.25mol
(1)反应为:Na2CO3+2HCl===2NaCl+H2O+CO2↑
2mol 22.4L
1.25mol V
则 2mol :1.25 mol=22.4L :V
V(CO2)=![]() =14L;
=14L;
(2)反应为:Na2CO3+HCl====NaHCO3+NaCl ①
NaHCO3+HCl====NaCl+H2O+CO2↑ ②
由反应①耗HCl1mol;生成NaHCO31mol,还余HCl为0.25mol;而反应②耗0.25molHCl应生成0.25molCO2。
所以V(CO2)=22.4Lmol•L×0.25mol=5.6L
答:(1)将A逐滴加入B中,生成CO2气体14L(标准状况);(2)将B逐滴加入A中,生成CO2气体为5.6L(标准状况)。
26.解:
两烧杯中的盐酸中,n(HCl)=5mol•L—1×0.06L=0.3mol
(1)若A为NaHCO3
①当a≤15时,即:n(CaCO3)=![]() =0.15mol,则盐酸过量
=0.15mol,则盐酸过量
x=![]() ×44=a-
×44=a-![]() ×44,解得x=1.176a
×44,解得x=1.176a
②当15<a≤18.6时,盐酸对CaCO3为不足量,对NaHCO3过量。
则有x―![]() x= a―
x= a―![]() ×44,解得x=2.1a-13.86
×44,解得x=2.1a-13.86
③当a>18.6时,盐酸对两种盐均为不足量。
则有x-0.3×4.4= a-![]() ×4.4
×4.4
解得: x= a+6.6
(2)若A为KHCO3,两烧杯内均无固体存在,则至少两种盐均完全反应,则:x≤15。
答:略。