第三节 元素周期表(课时一)
一、 选择题(每题只有1个正确答案)
1.在周期表中,第三、四、五、六周期元素的数目分别是( )
A.8、18、32、32 B、8、18、18、32
C、8、18、18、18 D、8、8、18、18
2.据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤—239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A.第3周期第IA族 B.第4周期第IA族
C.第5周期第IA族 D.第3周期第IIA族
3.元素周期表中前7周期的元素数如下( )
| 周 期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
请分析周期表与元素数的关系,然后预言第8周期最多可能含有的元素种数是
A.18 B.32 C.50 D.64
4.两种短周期元素A、B,可形成化合物的化学式为A2B2,则两种元素的原子序数之差不可能是( )
A.1 B.3 C.5 D.6
5.甲、乙是同一主族的两种元素,若 甲 的原子 序 数 为x,则乙的原子序数不可能是( )
A.x+2 B.x+4 C.x+8 D.x+18
二、选择题(每题有1~2个正确答案)
6.下列说法正确的是( )
A.原子序数越大,原子半径一定越大
B.电子层数多的原子的半径一定比电子层数少的大
C.原子序数大的原子,最外层电子数越多
D.元素原子最外层电子数越多(除稀有气体),可显示的化合价不一定越高
|
8.已知a为IIA族元素,b为IIIA族元素,它们的原子序数分别为m和n,且A.b为同一周期元素,下列关系式错误的是( )
A.n=m+11 B.n=m+25
C.n=m+10 D.n=m+1
9.A、B均是原子序数为1~18的元素中的一种,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是( )
A.n+4 B.n+6 C.n+8 D.n+10
10.在aXn-和bYm+两种简单离子,且X、Y均为短周期元素,已知Xn-比Ym+多2个电子层,下列关系和说法正确的是( )
A.X只能是第三周期元素 B.a-b+n+m的和只可能等于10
C.b不大于5 D.Y可能是第二周期元素
三、填空题:
11.已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?

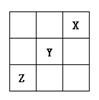
12.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的
 原子外电子数之和等于B原子的质子数,B原子核内
原子外电子数之和等于B原子的质子数,B原子核内
质子数和中子数相等,请回答下列问题
(1)写出A、B、C三种元素的名称
A ,B ,C 。
(2)B位于周期表中 周期 族
(3)C的原子结构示意图为
C的单质与水反应的化学方程式为
(4)比较B、C的原子半径为 > ,写出A的气态氢物与B的最高价氧化物对应的水化物反应的化学方程式
13.1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。按已知的原子结构规律,118号元素应是第___ ___周期第____ __族元素,它的单质在常温常压下最可能呈现的状态是____ ___(气、液、固选一填入)。近日传闻俄罗斯合成了第166号元素,若已知原子结构规律不变,该元素应是第_________周期第________元素。
第三节 元素周期表(课时二)
一、 选择题(每题只有1个正确答案)
1.以下互为同位素的是( )
A.金刚石与石墨 B.D2与H2
C.CO与CO2
D.![]() Cl与
Cl与![]() Cl
Cl
2.实际存在的![]() H、
H、![]() H、
H、![]() H、H+和H,它们是( )
H、H+和H,它们是( )
A.氢的五种同位素 B.五种氢元素
C.氢元素的五种不同微粒 D.氢的五种同素异形体
3.质量数为27的元素R,其核内有14个中子,则R可形成的离子为( )
A.R+ B.R2+ C.R3+ D.R2-
4.X元素能形成H2X和XO2 2种化合物,该元素的原子序数是( )
A.13 B.14 C.15 D.16
5.X、Y为短周期元素,两元素形成化合物XY2。已知其原子序数分别为a和b,则a不可能为( )
A. b+4 B.b-5 C. b-1 D. b+8
二、选择题(每题有1~2个正确答案)
6.下列各组元素中,按微粒半径递增顺序排列的是( )
A.Li、Na、K B.Ba2+、Ca2+、Mg2+
C.Ca2+、K+、Cl- D.N、O、F
7.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.X的原子序数比Y的小 B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大 D.X元素的最高正价比Y的小
8.A、B两种元素位于短周期,A原子半径小于B原子半径,两种元素可以形成A显正价的AB2型化合物,下列有关A、B两种元素的叙述中正确的是( )
A.A、B可能位于同一周期 B. A只能是金属元素
C.A只能位于B的下一周期
D. A可能是第二周期中的第ⅡA族元素,或第ⅣA族元素
9.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积在标准状况下为33.6L。在所生成的气体中,重氢D和普氢H的原子个数比为( )
A. 2:3 B.2:5 C.1:2 D. 1:3
10.X、Y、Z三种元素,它们的原子序数均小于20,X元素的原子最外电子层只有一个电子,Y元素的原子M层的电子数是K层和L层电子总数的1/2,Z元素原子L电子层比Y元素原子的L层少2个电子,由X、Y、Z组成的化合物的化学式不可能是( )
A.X2YZ2 B. XYZ3 C. X3YZ4 D. X4YZ4
三、填空题:
11.在![]() Li、
Li、![]() N、
N、![]() Na、
Na、![]() Mg、
Mg、![]() Li、
Li、![]() C几种核素中:
C几种核素中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
12.物质的量相同的H2O和D2O相比较,所含氧原子数之比为 ,相对分子质量之比为 ,质量之比为 ;与足量钠反应,放出的气体在标况下的质量之比为
13.由1H、2H、3H、35Cl、37Cl组成的氯化氢分子中,用精密的仪器检测这些分子,可测出____________种氯化氢分子,氯化氢分子的式量有____ ____种。
14.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
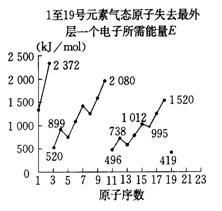 ⑴同主族内不同元素的E值变化的特点是 __ ___。
⑴同主族内不同元素的E值变化的特点是 __ ___。
各主族中E值的这种变化特点体现了元素性质的
____ __ ___变化规律。
⑵同周期内,随原子序数增大,E值增大,但个别元
素的E值出现反常现象,试预测下列关系式中正确
的是___________(填写编号,多选倒扣)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
⑶估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
__ _ ___<E<___ __。
⑷10号元素E值较大的原因是___________________________________。
第三节 元素周期表(课时三)
一、 选择题(每题只有1个正确答案)
1.下列叙述不正确的是( )
A.H2S、H2O、HF的稳定性依次增强
B.RbOH、KOH、Mg(OH)2的碱性依次减弱
C.Na+、Mg2+、Al3+的氧化性依次减弱
D.H4SiO4、H2CO3、H2SO4酸性依次增强
2.在IIA族中,Be是惟一可以生成含氧酸根(铍酸根离子:BeO22-)的元素,与铍的性质相似的短周期元素是 ( )
A.Na B.Mg C.Al D.Si
3.下列各组元素的原子随着原子序数的递增,有关递变不正确的是( )
A.原子半径:C>N>O>F B.金属性:Na<K<Rb<Cs
C.最高正价:P<S<Cl<Ar D.最外层电子数:Na<Mg<Al<Si
4.下表是X、Y、Z三种元素的氢化物的某些性质
| 元素 | 熔点/℃ | 沸点/℃ | 与水的反应 | 导电性(纯液体) |
| X | -283 | -162 | 不反应 | 不导电 |
| Y | -102 | 19 | 放热反应,形成酸性溶液 | 不导电 |
| Z | 680 | / | 剧烈反应,生成H2,并形成碱性溶液 | 导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是( )
A.X、Y、Z B. Z、X、Y C.Y、X、Z D.Z、Y、X
5.下列说法错误的是( )
A. 作半导体材料的元素大多数位于周期表中金属和非金属的交界处
B. 农药中常含有的元素通常在元素周期表的右上方区域内
C. 作催化剂材料的元素通常在元素周期表的左下方区域内
D. 在周期表过渡元素中可寻找到耐高温和耐腐蚀的合金材料
二、选择题(每题有1~2个正确答案)
6.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同主族元素,元素符号是Tl,以下对铊的单质及其化合物的性质推断不正确的是( )
A.铊是易导电的银白色金属 B.铊能生成+3价的阳离子
C.氢氧化铊是两性氢氧化物 D.Tl3+的氧化能力比Al3+强
7.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)是一种轻金属,它的氧化物对应的水化物可能具有两性
B.砹是一种有色固体,HAt很不稳定,AgAt是有色、难溶于水且感光性很强的固体
C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体物质
8.科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是( )
A.它的最外层电子数为4 B.它的金属性比铅强
C.它具有+2、+3、+4价 D.它的最高价氧化物的水化物是强酸
|
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
10.天然存在的金属钫(Fr)极微量。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )
A.已知元素中具有最大的原子半径 B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱 D.其单质的熔点比金属钠的熔点高
三、填空题:
11.某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的原子量约为______,它位于周期表中第______周期,第____族,它的最高价氧化物对应水化物的分子式为___ _,与同周期的相邻元素相比,它的酸性比____ _弱,比__ _强。
12.A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F
三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A____________,B____________,E____________。
(2)B的单质在F的单质中燃烧的现象是___ _________,
化学方程式是 _。
(3)A、C两种元素的最高价氧化物的水化物反应的离子方程式是
__。
第三节 元素周期表(课时四)
一、 选择题(每题只有1~2个正确答案)
1.氡是放射性稀有气体元素,氡气吸入体内有害健康,氡的核电荷数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”,是由质子数86,质量数219的原子组成,下列有关氡的说法正确的是( )
A.氡气在标准状况下密度约是19.82g/L
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有7个电子层,最外层有8个电子
D.“锕射气”是氡的同位素
2.已知钍(![]() Th)的原子可发生下列放射性变化:
Th)的原子可发生下列放射性变化:![]() Th—→
Th—→![]() X+
X+![]() He。对元素X的推测错误的是( )
He。对元素X的推测错误的是( )
A. X原子核外有6个电子层 B. X的碳酸正盐不溶于水
C. X的最高正价为+2价 D. X的氢氧化物是一种两性氢氧化物
3.A、B、C均为短周期元素,A、B两元素的阳离子和C的阴离子电子层结构相同,而A的阳离子半径比B的阳离子半径大,则3种元素原子序数大小顺序正确的是( )
A.A>B>C B.B>A>C C.C>B>A D.B>C>A
4.两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为( )
① m-4 ②m+4 ③m+8 ④m-2 ⑤m+6
A.①②④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
5.57号镧元素(La)是一种活动性比铁强的金属元素,它的氧化物化学式是La2O3;
它的氢氧化物La(OH)3是不溶于水的碱;它的氯化物和硝酸盐均溶于水。下列各组物质不能直接反应得到LaCl3的是( )
A. La2O3+HCl B. La+Cl2 C. La(OH)3+HCl D. La(NO3)3+HCl
6.下列各组顺序,正确的是( )
A. 微粒半径大小:S2- >Cl->F- >Na+>Al3+
B. 热稳定性大小:SiH4>PH3>NH3>H2O>HF
C. 熔点高低:石英>食盐>干冰>碘片
D. 等物质的量浓度溶液,酸性强弱顺序:HClO4>H2SO4>H3PO4>H2SiO3
二、填空题:
7.试推断下列化合物的化学式:
(1)第3周期内,A.B两元素的原子序数之差为4,它们组成的化合物AB的化学式为_____ ___________。
(2)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质的化学式为__________________________________________________________。
8.填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:___________________。
(2)周期表中位于第8纵行的铁元素属于第________族。
(3)周期表中最活泼的非金属元素位于第_____________纵行。
(4)所含元素超过18种的周期是第__________、_________周期。
9.现有前4个周期中的A、B、C、D、E五种元素,A的最高价氧化物的水化物含A40%,A原子中质子数等于中子数;B是同周期中除稀有气体元素外,原子半径最大的元素;B和D能形成BD型离子化合物,且B、D两离子的电子层结构相同;C和D能形成组成为CD3的化合物;C原子比E原子多1个电子;1.8gC与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子数比中子数少1;D原子比A原子多1个质子。回答下列问题:
⑴写出各元素的元素符号:A_______,B________,C________,D________,E________。
⑵C的原子结构示意图为________________,A的离子结构示意图为____________。
⑶五种元素所形成的简单离子中,还原性最强的是______,氧化性最强的是_______。
⑷五种元素所形成的最高价氧化物的水化物中,相互反应的离子方程式可表示为
“H++OH-==H2O”的两种物质的化学式为___________________________________。
三、计算题:
10.第IV主族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。求m、n的值,R的相对原子质量。
第三节 元素周期表
课时一:
一、二、选择题:
1.B 2.B 3.C 4.D 5.B 6.D 7.B 8.C 9.A 10.CD
三、填空题
11.第四周期第ⅠA族;第五周期第ⅦA族
12.(1)N S F(2)三、ⅥA
(3)![]() 、2F2 +2H2O==4HF + O2↑
、2F2 +2H2O==4HF + O2↑
(4)B、C,NH3+H2SO4==(NH4)2SO4
13.七; O; 气; 八;VIA
课时二:
一、二、选择题:
1.D 2.C 3.C 4.D 5.A 6.C 7. CD 8.D 9.D 10.AD
三、填空题:
11.(1)![]() Li、
Li、![]() Li(2)
Li(2)![]() N、
N、![]() C (3)
C (3)![]() Na、
Na、![]() Mg
Mg
12.1:1、18:20、18:20、1:2
13.6;5
14.⑴随着原子序数增大,E值变小 周期性 ⑵ ①③ ⑶ 419kJ/mol<E<738kJ/mol ⑷该元素原子的最外层电子排布已达到8电子稳定结构
课时三:
一、二、选择题:
1.C 2.C 3.C 4.B 5.C 6. CD 7.D 8.CD 9.D 10.BD
三、填空题:
11.31,三,ⅤA,H3PO4,H2SO4,H4SiO4
12.(1)Na; Mg; P (2)白烟、强光;2Mg+O2 = 2MgO
(3)Al(OH)3+OH-=AlO2-+2H2O
课时四:
一、选择题:
1.D 2.AD 3.C 4.D 5.D 6.AD
二、填空题:
7.(1)AIP (2)NaOH
8.(1)![]() O(2)Ⅷ(3)17(4)六、七
O(2)Ⅷ(3)17(4)六、七
9.⑴S K Al Cl Mg ⑵略 ⑶S2- Al3+ ⑷KOH、H2SO4 KOH、HClO4
三、计算题:
10.4、2,119