高一化学达标训练(第一章 化学反应及其能量变化)
一、选择题(每小题只有一个正确答案)
1二氧化硫是大气污染的主要有害物质之一,其来源主要是
A.大量矿石的开采 B.生态环境的破坏
C.工业上生产硫酸排放的尾气 D.工业上大量含硫物质的燃烧
【答案】 D
2钠在自然界中最主要的存在形式是
A.游离态 B.氯化钠 C.硫酸钠 D.硝酸钠
【答案】 B
3下列物质中,属于强电解质的是
A.醋酸 B.Fe(OH)3 C.H2O D.AgNO3
【答案】 D
4稀硫酸和氢氧化钡溶液混合,反应符合离子反应发生条件:①生成难溶的物质,②生成难电离的物质,③生成挥发性物质中的
A.①② B.①③ C.②③ D.①②③
【答案】 A
5下列阳离子中,氧化性最强的是
A.H+ B.Fe2+ C.Cu2+ D.Ag+
【解析】 金属越活泼,失电子后的阳离子就越难得电子,氧化性也就越弱,故Ag+氧化性最强。
【答案】 D
二、选择题(每小题有一个或两个正确答案)
6下列物质中,导电性最差的是
A.铜丝 B.稀硫酸 C.固态烧碱 D.熔融食盐
【解析】 导电性本质是要有自由移动离子或电子。A.铜丝中存在自由电子。B.稀硫酸中存在自由移动的离子。C.固态烧碱中的阴阳离子不能自由移动,导电性最差。D.熔融食盐存在自由移动的离子。
【答案】 C
7下列化学实验基本操作正确的是
A.称量前用游码来调节天平平衡
B.加热时,应把受热物质放在内焰部位
C.使用试管夹时,应将试管夹从试管底部往上套,夹在试管的中上部
D.给试管内液体加热时,液体体积不应超过试管容积的2/3
【答案】 C
8.下列说法中,不正确的是
A.焦炭在高温下与水蒸气的反应是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.化学反应的过程,都可以看成是“贮存”在物质内部的能量转化为热能而被释放出来
【答案】 CD
9.下列说法不正确的是
A.凡有单质参加的化合反应都是氧化还原反应
B.所有的复分解反应都是非氧化还原反应
C.盐酸在参加的反应中只能作氧化剂
D.金属在参加的反应中只能作还原剂
【解析】
盐酸中![]()
![]() ,-1价Cl可失去电子被氧化,盐酸既可作氧化剂,也可作还原剂。金属在反应中只能失去电子作还原剂。
,-1价Cl可失去电子被氧化,盐酸既可作氧化剂,也可作还原剂。金属在反应中只能失去电子作还原剂。
【答案】 C
10.有下列氧化还原反应:
①Fe+CuSO4====Cu+FeSO4
②Cu+2FeCl3====CuCl2+2FeCl2
③2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O
④2FeCl2+Cl2====2FeCl3
根据上述反应可判断各粒子的氧化性由强到弱的顺序正确的是
A.MnO![]() >Cl2>Fe3+>Cu2+>Fe2+ B.Cl2>MnO
>Cl2>Fe3+>Cu2+>Fe2+ B.Cl2>MnO![]() >Cu2+>Fe2+>Fe3+
>Cu2+>Fe2+>Fe3+
C.MnO![]() >Fe3+>Cu2+>Cl2>Fe2+ D.Fe3+>MnO
>Fe3+>Cu2+>Cl2>Fe2+ D.Fe3+>MnO![]() >Cl2>Cu2+>Fe2+
>Cl2>Cu2+>Fe2+
【解析】
根据“两强变两弱”比较方法,由①式知氧化性Cu2+>Fe2+,由②知氧化性Fe3+>Cu2+,③式知氧化性MnO![]() >Cl2,④式知氧化性Cl2>Fe3+,故A项正确。
>Cl2,④式知氧化性Cl2>Fe3+,故A项正确。
【答案】 A
11.亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的产物是
A.N2 B.N2O3 C.NH3 D.NO2
【解析】 亚硝酸中N呈现+3价,当它作氧化剂得电子,化合价要降低。N2中N呈0价,N2O3中N呈+3价,NH3中N呈-3价,NO2中N呈现+4价。故还原产物可能是N2或NH3。
【答案】 AC
12.下列各组离子在溶液中可以大量共存的是
A.H+、SO![]() 、CO
、CO![]() 、SO
、SO![]() B.Cu2+、Cl-、NO
B.Cu2+、Cl-、NO![]() 、CO
、CO![]()
C.Mg2+、H+、SO![]() 、Cl- D.Mg2+、OH-、CO
、Cl- D.Mg2+、OH-、CO![]() 、H+
、H+
【解析】 A选项中SO![]() 、CO
、CO![]() 与H+;B选项中Cu2+与CO
与H+;B选项中Cu2+与CO![]() ;D选项中Mg2+与OH-、CO
;D选项中Mg2+与OH-、CO![]() ,H+与OH-,H+与CO
,H+与OH-,H+与CO![]() 均不能大量共存。
均不能大量共存。
【答案】 C
13.下列离子方程式正确的是
A.碳酸钡溶于稀盐酸:CO![]() +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
B.铝和稀硫酸反应:2Al+6H+====2Al3++3H2↑
C.铜跟硝酸银溶液反应:Cu+Ag+====Cu2++Ag
D.氯化镁溶液跟NaOH溶液反应:Mg2++2OH-====Mg(OH)2↓
【解析】 BaCO3难溶于水,不能改写成CO![]() ;C项电荷不守恒。
;C项电荷不守恒。
【答案】 BD
三、选择题(每小题只有一个正确答案)
14.对溶液中的离子反应,下列说法正确的是
①不可能是氧化还原反应 ②只能是复分解反应 ③可能是置换反应 ④不能没有分子参加
A.①③ B.③ C.①② D.③④
【解析】
此类练习,只要能迅速、准确地举出反例即可求出答案。①Zn+2H+====Zn2++H2↑是氧化还原反应所以①不正确;②不一定是复分解反应MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;③正确例如①;④不正确,例如BaCl2+Na2SO4====BaSO4↓+2NaCl,无分子参加。
Mn2++Cl2↑+2H2O;③正确例如①;④不正确,例如BaCl2+Na2SO4====BaSO4↓+2NaCl,无分子参加。
【答案】 B
15.下列关于强、弱电解质的叙述正确的是
A.强酸、强碱及大部分盐类属于强电解质,弱酸弱碱属于弱电解质
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.SO2的水溶液能导电,所以SO2是电解质
【解析】 B选项中所有的共价化合物都是弱电解质不对,如HCl、H2SO4等都是强电解质;D选项中SO2的水溶液能导电,是因为SO2跟水反应生成了电解质H2SO3,SO2本身无法电离。
【答案】 A
16.有人预言:H2是21世纪最理想的能源,其根据不正确的是
A.生产H2的原料来源广阔
B.在等质量的可燃气体中,H2燃烧时放出的热量多
C.H2易液化,携带方便
D.燃烧时无污染
【答案】 C
17.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是
A.2Fe3++SO2+2H2O====2Fe2++SO![]() +4H+
+4H+
B.I2+SO2+2H2O====H2SO4+2HI
C.H2O2+H2SO4====SO2↑+O2↑+2H2O
D.2Fe2++Cl2====2Fe3++2Cl-
【解析】 判断的依据就是排查A~D中还原能力的顺序,看与题给信息是否吻合。
A中SO2>Fe2+;B中SO2>I-;C中H2O2>SO2;D中Fe2+>Cl-,故C不能发生。
【答案】 C
18.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生反应2FeCl3+Cu====2FeCl2+CuCl2。FeCl3溶液跟铁粉也能反应2FeCl3+Fe====3FeCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
【解析】 FeCl3跟Fe、Cu都能反应,因铁的还原性比铜强,在氯化铁溶液中同时加入铁粉和铜粉时,首先被氧化的是Fe,即Fe+2FeCl3====3FeCl2,铁反应完后,铜被氧化:Cu+2FeCl3====2FeCl2+CuCl2。如无FeCl3,铁粉过剩,Fe还能跟CuCl2发生置换反应,故B项不可能。
【答案】 B
19反应8NH3+3Cl2====6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是
A.3∶1 B.1∶3 C.1∶1 D.3∶8
【解析】 在反应中,8个NH3分子,只有2个变成N2,另6个变成NH4Cl未发生价变。
【答案】 B
20.用托盘天平称得某物质的质量为6.5 g。如果发现砝码和固体物质的位置放反了,则该物质的实际质量是
A.5.5 g B.7 g C.6 g D.7.5 g
【答案】 A
四、实验题(本题包括4小题)
21.(1)在烧杯或试管里进行固体物质的溶解时,为了加快溶解速度,常采用的方法有 、 、 。
(2)假设液体的刻度在滴定管的位置是20 mL(此滴定管规格是50 mL),全放出后,液体的体积是30 mL吗,为什么?
【答案】 (1)粉碎固体 加热 搅拌或振荡等
(2)体积大于30 mL,因为“50 mL”刻度下还有一段无刻度。
22.用下列方法制取氧气,正确的操作顺序的序号是
①加热,用排水法收集一试管氧气
②称取1.2 g KClO3与制得的CuO粉末混合均匀后,装入大试管,用带有导管的单孔橡胶塞塞紧。
③装配好实验装置,检查装置的气密性。
④撤出导气管。
⑤停止加热。
⑥用带火星的木条伸入试管中检验收集的氧气。
【答案】 ③②①④⑤⑥
23.除去下列物质中的杂质(括号内),写出选用的试剂及反应的离子方程式。
(1)NaCl(Na2CO3)
(2)Na2CO3(NaOH)
(3)CaCl2(CaCO3)
(4)Cu(Fe)
【答案】 (1)HCl CO![]() +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
(2)CO2 CO2+2OH-====CO![]() +H2O
+H2O
(3)HCl CaCO3+2H+====Ca2++CO2↑+H2O
(4)HCl Fe+2H+====Fe2++H2↑
24.请设计一个只用BaCl2溶液及试管鉴别Na2CO3溶液和稀H2SO4的实验,简要写出鉴别过程和实验结论。
【解析】 BaCl2都能跟Na2CO3、H2SO4反应产生白色沉淀,靠此是无法鉴别的。但题目要求只用BaCl2溶液,暗示反应后可能有办法。
因BaCl2+H2SO4====BaSO4↓+2HCl
而BaCO3沉淀能溶解于稀盐酸中,靠此可以鉴别。
【答案】 取两种待鉴溶液于两支试管中,分别滴加BaCl2试剂,都产生白色沉淀,静止,待沉淀沉于管底后,倒出各自的上层清液,分别滴加到另一支试管里的沉淀中,看沉淀是否溶解,溶解者为BaCO3沉淀,则该试管原盛试剂是Na2CO3。
Ba2++CO![]() ====BaCO3↓
====BaCO3↓
BaCO3+2H+====Ba2++CO2↑+H2O
Ba2++SO![]() ====BaSO4↓
====BaSO4↓
五、推断题(本题包括2小题)
25.某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO![]() 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。
乙厂的废水中含有另外三种离子是 、 、 。
有一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
【解析】 本题旨在考查学生对离子反应、离子共存掌握的情况,可以看作是对“离子共存”的变体考查。同时兼顾对解决日常生产实际中问题的能力考查。
甲厂废水明显呈碱性,说明含有大量OH-,则Ag+、Fe3+因与之反应而不能共存,阳离子只可能含有K+,另一种离子尚须待定。
乙厂中含有另外三种离子,结合甲中分析,一定含有Ag+、Fe3+,而Ag+与Cl-不能大量共存,故阴离子只可能是NO![]() ,故Cl-属于甲厂废水中。
,故Cl-属于甲厂废水中。
甲乙两厂的废水按适当比例混合,因Ag+与Cl-、Fe3+与OH-反应转化为沉淀而滤去,故余KNO3(钾肥、氮肥)作为化肥可用来浇灌农田。
【答案】 甲:OH- K+ Cl-
乙:Ag+ Fe3+ NO![]()
Ag+与Cl-、Fe3+与OH- K+、NO![]() (或KNO3)
(或KNO3)
26.有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO![]() 、SO
、SO![]() (每种离子只能用一次),现将溶液两两混合,记录现象如下:
(每种离子只能用一次),现将溶液两两混合,记录现象如下:
A+B![]() 白色沉淀,A+C
白色沉淀,A+C![]() 白色沉淀
白色沉淀
B+D![]() 白色沉淀,A+D
白色沉淀,A+D![]() 白色沉淀
白色沉淀
C+D![]() 蓝色沉淀。已知Ag2SO4是微溶性白色沉淀,则A、B、C、D的化学式分别是 、
、 、
。
蓝色沉淀。已知Ag2SO4是微溶性白色沉淀,则A、B、C、D的化学式分别是 、
、 、
。
【解析】
首先考虑离子间的共存情况。Ag+与Cl-、OH-、SO![]() 都产生沉淀,故只能与NO
都产生沉淀,故只能与NO![]() 组合成AgNO3;Mg2+、Cu2+都不能与OH-共存,则OH-只能与Na+组合成NaOH;余Cl-、SO
组合成AgNO3;Mg2+、Cu2+都不能与OH-共存,则OH-只能与Na+组合成NaOH;余Cl-、SO![]() 与Mg2+、Cu2+组合。
与Mg2+、Cu2+组合。
因A能与B、C、D都产生白色沉淀,说明A是AgNO3,NaOH虽也能与其他三种溶液产生沉淀,但Cu(OH)2是蓝色的。
C+D![]() 蓝色沉淀,说明C与D的组合是NaOH与Cu2+反应。若C是NaOH,D是Cu2+,则B是Mg2+,因B与A产生沉淀,B应为MgCl2,D应是CuSO4,B+D就无法产生沉淀。若D是NaOH,C是Cu2+,则B应为MgCl2,C是CuSO4,B+D
蓝色沉淀,说明C与D的组合是NaOH与Cu2+反应。若C是NaOH,D是Cu2+,则B是Mg2+,因B与A产生沉淀,B应为MgCl2,D应是CuSO4,B+D就无法产生沉淀。若D是NaOH,C是Cu2+,则B应为MgCl2,C是CuSO4,B+D![]() Mg(OH)2↓。经验证此情况符合条件。
Mg(OH)2↓。经验证此情况符合条件。
【答案】 AgNO3 MgCl2 CuSO4 NaOH
六、计算题(本题包括2小题)
27.用浓氨水与氯气反应,其化学方程式为3Cl2+8NH3====6NH4Cl+N2。
(1)标出电子转移的方向和数目。
(2)当有160.5 g NH4Cl产生时,被氧化的氨气是多少克?
【答案】
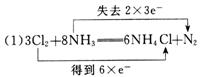
(2)17 g
28.美国《科学美国人》杂志在1971年7月刊登的“地球的能量资源”一文中提供了如下数据:
到达地球表面的太阳辐射能的几条主要去路
| 直接反射 | 52,000×109 kJ·s-1 |
| 以热能方式离开地球 | 81,000×109 kJ·s-1 |
| 水循环 | 40,000×109 kJ·s-1 |
| 大气流动 | 370×109 kJ·s-1 |
| 光合作用 | 40×109 kJ·s-1 |
请选用以上数据计算:
(1)地球对太阳能的利用率约为 。
(2)通过光合作用,每年有 千焦的太阳能转化为化学能(每年按365天计)。
【解析】 地球对太阳能利用率包括水循环、大气流动、光合作用三部分。
【答案】 (1)23.3% (2)1.26×1018