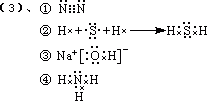高一化学单元测试
第五章:物质结构、元素周期律
可能用到的相对原子质量:H:1 C:12 O:16 S:32 N:14
第I卷(选择题,共48分)
一、选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
1、据报导我国最近合成多种元素的新的同位素,其中一种是![]() (铪),它的中子数是( )
(铪),它的中子数是( )
A.72 B.113 C.185 D.257
2、N和C的原子半径( )
A.大于 B.小于 C.等于 D.不能肯定
3、![]() 的原子核外电子数( )
的原子核外电子数( )
A.大于 B.小于 C.等于 D.不能肯定
4、下列微粒中与OH-离子具有相同的质子数和相同的电子数,该微粒可能为( )
A.F- B.Mg2+ C.NH4+ D.CH4
5、元素X的原子核外M电子层有3个电子,元素Y2-离子核外共有18个电子,则这两种元素可形成的化合物为( )
A.XY2 B.X2Y C.X2Y3 D.X3Y
6、在核电荷数为1~20的元素中,最外层电子数和电层数相等的元素共有( )
A.3种 B.4种 C.5种 D.6种
二、选择题(本题包括10小题,每小题3分,共30分,每小题有一个或两个选项符合题意)
7、下列各组顺序的排列不正确的是( )
A.离子半径:Na+>Mg2+>Al3+>F-
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO3<H2CO3<H3PO4
D.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
8、同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z
B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:X>Y>Z
9、A+、B2+、C-、D2-四种离子具有相同的电子层结构。现有以下排列顺序:①B2+>A+>C->D2-;②C->D2->A+>B2+;③B2+>A+>D2->C-;④D2->C->A+>B2+,四种离子的半径由大到小以及四种元素的原子序数由大到小的顺序分别是( )
A.①④ B.④①
C.②③ D.③②
10、已知X、Y、Z三元素为同周期中相邻主族元素,且原子序数按X、Y、Z依次增大。已知X的氧化物对应水化物呈弱碱性,Z是同周期元素中非金属性最弱的非金属元素,关于元素Y,下列说法中正确的是( )
A.Y的氢氧化物一定具有两性
B.Y是金属元素,且既溶于酸,又溶于强碱
C.Y单质能与水剧烈反应,并放出氢气
D.Y元素能与氢元素形成稳定的氢化物
D.质量数为16的一类原子
11、对于同位素的概念,下列叙述中正确的是( )
A.原子序数相等,化学性质与质量数不同
B.原子序数相等,并有相同的化学性质和相同的质量数
C.原子序数相等,化学性质几乎完全相同,而中子数不同
D.化学性质相同,而质量数与原子序数不同
12、核电荷数1~19的元素中,下列叙述不正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素不一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.核电荷数为17的元素的原子容易获得1个电子
13、 农作物的生长需要铁、锰、锌、铜、钼等元素,它们或是酶的组成成分,或能提高酶的活性,对提高农产品的品质有重要作用。硼肥主要是硼酸和硼砂,可直接将其水溶液施入土壤中,在Mg、Al、Si中和硼元素属于同主族的元素是Al。常用的铜肥是胆矾,在盐碱地(土壤pH>7)施用胆矾时宜将溶液“喷在叶上”主要理由是( )。
A.CuSO4溶液呈酸性,会损伤植物的根部
B.Cu2+在碱性条件下生成不溶物,作物根部无法吸收
C.Cu2+在碱性土壤中不易流失,有利于作物迅速吸收
D.氢氧化铜易溶于水,能在土壤中被根吸收
14、两种短周期元素组成的化合物中,原子个数比为1∶3,若两种元素的原子序数分别为a和b,则a和b的关系中可能是( )。
①a=b+5 ②a+b=30 ③a+b=8 ④a-b=8
A.②③ B.②③④ C.①②③④ D.③④
15、硼有两种天然稳定同位素![]() 、
、![]() ,硼元素的近似相对原子质量为
,硼元素的近似相对原子质量为
10.80,则对硼元素中![]() 的质量分数判断正确的是( )。
的质量分数判断正确的是( )。
A.20% B.略大于20%
C.略小于20% D.80%
16、下列关于化学键的说法正确的是( )。
A.组成单质的分子内一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定为极性键
第Ⅱ卷(非选择题 52分)
四、填空题
13(6分)、判断并写出下列微粒符号:(各举三例)
(1)、含10个电子的阳离子__________________________;
(2)、含10个电子的阴离子__________________________;
(3)、含10个电子的化合物分子____________________________。
14(10分)、A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素,A与E元素的最外层电子数都只有一个。且A元素的单质是最轻的气体,B和D元素原子最外层电子数相同。B元素原子L层电子数是K层电子数的三倍,C元素原子最外层电子数是D元素最外层电子数的一半。请推知:(填元素符号)
A.________ B._________ C.________ D.__________ E.__________。
15(4分)、A元素是IA族元素中相对原子质量最小的元素,B元素原子的最外层电子数是次外层的3倍,A、B两元素可形成常见化合物分子。
(1)、用电子式表示这两种分子的形成过程。
________________________________________;
(2)、这种分子的结构式分别为_________________。
16、填写下列空白(8分)
1)、写出元素周期表中含有8个质子、10个中子的化学符号__________。
2)、周期表中位于第八纵行的铁元素属于第_____________族。
3)、周期表中最活泼的非金属元素位于第_________________纵行。
4)、所含元素超过18种的周期是第_____________________周期。
17、(8分)B、C三种元素为短周期元素。1mol B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是__________;B的最高价氧化物的对应水化物的化学式为__________。C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是__________;C与Na反应后生成物中的化学键属于__________。
18、已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)、写出五种元素的元素符号:A__________、B_________、C____________、D__________、E________________。
(2)、用电子式表示离子化合物A2B的形成过程:_____________________________。
(3)、写出下列物质的电子式:
1) D 形成分子________________________________-______
2)C、E形成的化合物:____________________________________
3)A、B、E形成的化合物______________________________
4)D、E形成的化合物__________________________。
[参考答案]
1B 2B 3C 4A 5C 6A 7A 8BD 9B 10AB 11C 12A
13、1)Na+、 Mg2+、 Al3+、 H3O+、 NH4+
2)F-、 O2-、 OH-、 N3-、 NH2-
3)CH4、 NH3、 H2O、 HF
14、A、 H B、 O C、 Al D、 S E、 K
15、
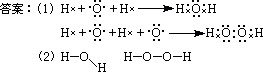
16、1)188O 2)Ⅷ 3)十七 4)六、七
17、Al Al(OH)3 S 离子键
18答案:(1)、A、Na B、O C、S D、N E、H
![]() (2)、
(2)、