高一化学单元检测题2
一、选择题
1.在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后( )
A.溶液为紫色 B.汽油层呈橙色
C.汽油层呈紫红色 D.溶液为橙色
2.下列制取氯气的方法可行的是( )
A.加热氯酸钾
B.浓盐酸中加入浓硫酸并加热
C.在二氧化锰中加入浓盐酸并加热
D.高锰酸钾与浓盐酸混合
3.卤素单质(从氟到碘)性质的递变规律正确的是( )
A.密度逐渐减小,颜色逐渐加深
B.氧化性逐渐减弱
C.还原性逐渐减弱
D.与氢化合条件逐渐困难
4.下列物质属于纯净物的是( )
A.漂白粉 B.盐酸 C.碘酒 D.液氯
5.下列不能用金属跟盐酸直接反应来制取的氯化物是( )
A.氯化铁 B.氯化银 C.氯化铝 D.氯化钠
6.实验室制取氯气可以有以下途径,用化学方程式表示如下。其中实验室常用的是( )若制取等质量的氯气,消耗盐酸最少的是( )
A.8HCl+K2Cr2O7![]() 2KCl+Cr2O3+4H2O+3Cl2↑
2KCl+Cr2O3+4H2O+3Cl2↑
B.16HCl+2KMnO4![]() 2MnCl2+8H2O+2KCl+5Cl2↑
2MnCl2+8H2O+2KCl+5Cl2↑
C.4HCl+MnO2![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.6HCl+KClO3![]() KCl+3H2O+3Cl2↑
KCl+3H2O+3Cl2↑
7.下列关于氯水的叙述正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡放出,该气体是Cl2
D.氯水放置数天后pH值将变小
8.某温度下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl,则反应前后容器中压强比应接近( )
A.1:11 B.11:1 C.7:11 D.11:7
9.下列试剂不能把NaCl和KI两种溶液鉴别开的是( )
A.氯水 B.硝酸银溶液 C.石蕊试液 D.淀粉溶液
10.下列物质与其用途相符合的是( )
①Cl2—做消毒剂 ②AgBr—制胶卷,感光纸 ③AgI—人工降雨 ④碘—预防甲状腺肿大 ⑤淀粉—检验I2的存在 ⑥NaClO—漂白纺织物
A.②③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.全部
11.(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:
F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2 下列方程式中错误的是( )
A.2NaSCN+MnO2+2H2SO4![]() Na2SO4+(SCN)2↑+MnSO4+2H2O
Na2SO4+(SCN)2↑+MnSO4+2H2O
B.(CN)2+2KI![]() 2KCN+I2
2KCN+I2
C.Cl2+2NaOCN![]() (OCN)2+2NaCl
(OCN)2+2NaCl
D.2AgCN![]() 2Ag+(CN)2
2Ag+(CN)2
12.有两种卤素单质共1mol,跟氢气在一定条件下完全反应后生成的卤化氢的平均式量为38.5,则该两种卤素单质可能是( )
 A.F2和Cl2 B.F2和Br2
C.Cl2和Br2 D.Br2和I2
A.F2和Cl2 B.F2和Br2
C.Cl2和Br2 D.Br2和I2
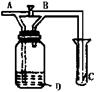
13.如图所示,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是( )
A.浓H2SO4 B.NaOH溶液
C.H2O D.饱和NaCl溶液
14.在密闭容器中,盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得盐酸的质量分数为25.26%,则容器中原有H2、O2、Cl2的物质的量之比是( )
A.6:3:1 B.9:4:1
C.13:6:1 D.10:6:1
15.由两种氯化物组成的混合物1g,与足量的AgNO3溶液反应,生成2g AgCl沉淀,此混合物可能是( )
A.ZnCl2和HgCl2 B.ZnCl2和AlCl3
C.HgCl2和BaCl2 D.AlCl3和FeCl3
16.不能使溴水变为无色溶液的是( )
A.CCl4 B.KOH溶液
C.FeCl2溶液 D.KI溶液
17.向含有1.17g NaCl和1.17g NaF的溶液中,加入过量的AgNO3溶液,将析出的沉淀过滤、洗涤、干燥后称其质量为2.87g。根据此实验确定AgF在水中的溶解性应为( )
A.易溶于水 B.此AgCl更难溶于水
C.与AgCl一样难溶于水 D.无法确定
18.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )
①Cl2+2KI![]() I2+2KCl ②2FeCl3+2HI
I2+2KCl ②2FeCl3+2HI![]() I2+2FeCl2+2HCl
I2+2FeCl2+2HCl
③2FeCl2+Cl2![]() 2FeCl3 ④I2+SO2+2H2O
2FeCl3 ④I2+SO2+2H2O![]() 2HI+H2SO4
2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
19.有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份加入盐酸化的BaCl2溶液,出现白色沉淀,另一份加入HNO3酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是( )
(1)原气体中肯定有SO2 (2)原气体中可能有SO2 (3)原气体中肯定没有H2S、HBr
(4)不能肯定原气体中是否有HCl (5)原气体中肯定没有CO2 (6)原气体中肯定有HCl
A.(1)(3)(4) B.(2)(4)(5)
C.(1)(3)(6) D.(1)(3)(5)(6)
20.根据下列反应:
(1)FeCl3+2HI![]() 2FeCl2+I2+2HCl
2FeCl2+I2+2HCl
(2)2KMnO4+16HCl![]() 2MnCl2+5Cl2↑+2KCl+8H2O
2MnCl2+5Cl2↑+2KCl+8H2O
(3)2FeCl2+Cl2![]() 2FeCl3
2FeCl3
若要从含有Fe2+、I-、Cl-的混合溶液中,只除去I-,而Fe2+和Cl-不被氧化,应向混合溶液中加入( )
A.KMnO4 B.Cl2
C.FeCl3 D.HCl
二、填空题
21.下图表示某些物质间的反应关系
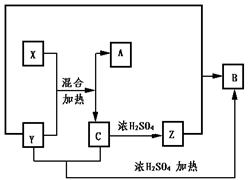
已知无色晶体X和黑色固体Y混合共热是实验室制备气体A的常用方法,黑色固体Y和Z的浓溶液共热也是实验室制备气体B的常用方法,已知X和C做焰色反应均出现紫色火焰,(隔着蓝色钴玻璃)试回答下列问题
(1)填写化学式:X Y
Z
A B C
(2)写出有关化学方程式
22.十八世纪70年代,瑞典化学家舍勒在研究一种白色银盐时发现,在黑暗中此盐无气味,而在光照时逐渐变黑,并有刺激性气味,此银盐是 。
23.在盛有AgNO3、HBr、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如下表所列:
| ① | ② | ③ | ④ | ⑤ | |
| ① | —— | 无色气体 | 白色沉淀 | 白色沉淀 | 无明显现象 |
| ② | 无色气体 | —— | 无明显现象 | 淡黄色沉淀 | 无明显现象 |
| ③ | 白色沉淀 | 无明显现象 | —— | 白色沉淀 | 无明显现象 |
| ④ | 白色沉淀 | 淡黄色沉淀 | 白色沉淀 | —— | 黄色沉淀 |
| ⑤ | 无明显现象 | 无明显现象 | 无明显现象 | 黄色沉淀 | —— |
| 结论 |
请在该表的“结论”中填写这些编号所代表的化学式
三、计算题
24.工业上常用漂白粉跟酸反应放出的氯气的质量分数x%来表示漂白粉的优劣。漂白粉与酸反应为:
Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2H2O+2Cl2↑
2CaSO4+2H2O+2Cl2↑
现为了测定一瓶漂白粉的x%,进行了如下实验。称取漂白粉样品2.00g,加水研磨后,转入250mL容量瓶内,用水稀释至刻度。摇匀后,取出25.0mL,加入过量的KI溶液和过量的稀H2SO4,静置。待漂白粉放出的氯气与KI完全反应后,用0.100mol/L Na2S2O3溶液20.0mL。试由上述数据计算该漂白粉的x%。
参考答案
一、1.B 2.CD 3.BD 4.D 5.AB 6.D 7.BD 8.B 9.CD 10.D 11.C 12.BC 13.AB 14.C 15.A 16.CD 17.A 18.C 19.A 20.C
二、21.(1)KClO3 MnO2 HCl O2 Cl2 KCl
(2)2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2KCl+H2SO4(浓)![]() K2SO4+MnSO4+Cl2↑+2H2O
K2SO4+MnSO4+Cl2↑+2H2O
2KCl+MnO2+2H2SO4(浓)![]() KHSOO4+HCl↑
KHSOO4+HCl↑
MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
22.AgCl 23. Na2CO3HBr CaCl2 AgNO3 NaI
三、24.35.5%