高一第2学期期末考试化学试卷
l 考试时间100分钟,试卷总分100分。
l 选择题部分请涂答题卡,其余直接写在答卷上。不按要求答卷不计分;
l 可能用到的相对原子质量:
H-1, C-12, N-14, O-16, Cl-35.5, Br-80
Ⅰ卷 选择题
一、选择题(每小题只有一个选项符合题意。)
1.随着卤素原子半径的增大,下列递变规律正确的是
A.单质熔沸点逐渐降低 B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
2.下列物质中,具有非极性键的离子化合物是
A.H2O2 B.MgF2 C.NaOH D.Na2O2
3.下列叙述正确的是
A.在共价化合物中一定存在共价键 B.在气态单质分子中一定存在共价键
C.含有共价键的化合物一定是共价化合物 D.离子化合物中只含有离子键
4.实验室欲快速制取氢气,应采取的措施是
A .纯锌和稀硫酸反应 B.含铜、铅等杂质的粗锌和稀硫酸反应
C. 纯锌和浓硫酸反应 D.粗锌和稀硝酸反应
5.下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应只有在加热条件下才能发生
6.下列各组分子中的各个原子,或者处于同一平面,或者在一条直线上的是( )
A.C6H6,C2H4,C2H2 B.CH4,HCl,H2C=CHCH3
C.C6H6,HCl,CH4 D.C2H6、HCl、C2H4
7.某烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称是
A.3,3-二甲基-1-丁炔 B.2,3-二甲基-2-丁烯
C.2,3-二甲基-1-丁炔 D.2,3-二甲基-1-丁烯
8.等质量的乙烯和聚乙烯完全燃烧消耗的氧气的物质的量,前者和后者的关系是( ).
A.前者大 B.后者大 C.相等 D.不能肯定
二、选择题(每小题有一至两个选项符合题意。)
9.主链含有5个碳原子,并有甲基、乙基2个支链的烷烃有
A 、2种 B 、3种 C 、4种 D 、5种
10.设NA为阿伏加德罗常数,下列有关叙述正确的是
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.1mol甲烷的质量与NA个甲烷分子的质量之和相等
C.28g氮气含有的原子数目为NA
D.1mol碳正离子CH5+所含的电子总数为8NA
11.两种金属A与B组成原电池时,A是正极。下列有关推断正确的是
A. A的金属性强于B
B. A电极上发生的电极反应是还原反应
C. 电子不断由A电极经外电路流向B电极
D. A在金属性活动顺序表中一定排在氢前面
12.随着碳原子数的增多,碳元素的质量百分含量也增大的是
A.烷烃同系物 B.烯烃同系物 C.炔烃同系物 D.苯的同系物
13. CaC2 和ZnC2、Al4C3、Mg 2C3、Li 2C2等都同属于离子型碳化物。请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A.ZnC2与水反应生成乙烷(C2H6) B.Al4C3与水反应生成甲烷(CH4)
C.Mg 2C3与水反应生成丙炔(C3H4) D.Li 2C2与水反应生成乙烯(C2H4)
14.对相对分子质量为104的烃的下列说法中,正确的组合是( )
①可能是芳香烃②可能发生加聚反应③分子中不可能都是单键④分子中可能都是单键
A.只有①② B.只有①③ C.只有①②③ D.只有①②④
15.下列各组液体混和物混和后,液体不分层的是( )
A.苯和水 B.苯和液溴 C.已烷和溴水 D.苯和硝基苯
16.常温常压下10毫升气态烃与50毫升氧气(过量)混合并点燃,恢复到原来的状态时剩余35毫升气体,则此烃不可能是( )
A.C2H6 B.C3H6 C.C3H8 D.C4H6
Ⅱ卷 非选择题
三、填空题
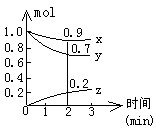 17.某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
17.某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(1)计算反应开始2min内的![]() =
,
=
,
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
18.2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃复分解反应研究方面所取得的成绩。他们的研究成果是朝着“绿色化学”方向前进了一大步。烯烃复分解反应是两种物质交换成分生成两种新物质的反应。如AB+CD→AC+BD(不考虑基团的电荷,与四种基本反应中复分解反应有所区别)。类似的两种烯烃交换双键两端的基团,从而生成两种新的烯烃便是烯烃复分解反应。如:
CH2=CHR1+CH2=CHR2 ![]() CH2=CH2+R1CH=CHR2。
CH2=CH2+R1CH=CHR2。
请回答下列问题:
(1)根据系统命名法,化合物(CH3)2CHCH=CH2的名称是 。
(2)选择易于使用(常温常压下对空气稳定)的金属有机物为催化剂,(CH3)2CHCH=CH2可以在温和条件下发生烯烃复分解反应,且副产物很少。写出该烯烃自身发生烯烃复分解反应的化学方程式 。
(3) 在(2)反应中的相对分子质量较大的产物经催化加氢后的一氯取代物有 种;
另一产物的用途 、 (举二例)。
(4)烯烃复分解反应在高分子材料化学、有机合成化学等方面具有重要意义。下列关于烯烃复分解反应的说法错误的是 。
A.所涉及的反应步骤、所需资源相对减少,使反应效率提高。
B.烯烃复分解反应与四种基本反应中的复分解反应完全相同。
C.烯烃复分解反应中产生较少有害物质,减少对环境的影响。
D.已经发现的催化剂在空气中稳定,使烯烃复分解反应技术得以普及。
19.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下转化关系:
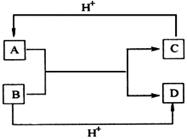
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的结构式_ _____;D的电子式_ _____。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离子方程式__ ____;
(3)已知肼(H2N-NH2)和甲胺(CH3-NH2 )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):___ ___。
20.某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
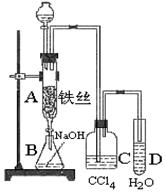
(1) 写出反应容器A中发生的化学反应方程式: 。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
,写出有关的化学方程式 。
(3)C中盛放CCl4的作用是 。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应的方法是 。
四、计算题
21.某含有气态单烯烃A和另一气态烷烃B的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将3.36L混合气体通过足量的溴水中,结果溴水增重2.52g,试确定原混合气体中A、B的分子式并计算混合气体中各烃的体积分数。
22.125℃101KPa时,2L烃A(CxHy)的蒸气能在mLO2中完全燃烧,反应后体积变化至(m+2)L(体积均在同样的条件下测定)。请回答:
(1)烃A在组成上应满足的条件是① ;② ;
(2)当m=7时,该烃可能的分子式为 ;
(3)若A在常温常压下为气态,则m的取值范围是 。
第2学期
高一期末考试化学试卷答卷纸
班级_________ 姓名_____________ 学号__________ 得分_______
三、填空题
17. (1)计算反应开始2min内的![]() =
,
=
,
(2)容器内的反应物是 。
(3)该反应的化学方程式 。
18. (1)名称是 。
(2)化学方程式为 。
(3)一氯取代物有 种;
另一产物的用途 、 (举二例)。
(4) 。
19. (1)A的结构式_ _____;D的电子式_ _____。
(2)离子方程式__ 。
(3)结构简式:___ ___。(至少写两个)
20. (1)化学反应方程式:
。
(2) 目的是 ,
有关的化学方程式 。
(3)C中盛放CCl4的作用是 。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应的方法是
。
四、计算题
21.
22. (1)烃A(CxHy)在组成上应满足的条件是① ;
② ;
(2)当m=7时,该烃可能的分子式为 ;
(3)若A在常温常压下为气态,则m的取值范围是 。