高一第2章 碱金属综合测试
班级 姓名 学号
一、选择题
1.(2003年全国理综)不属于碱金属元素的是 ( D)
A.Li B.Na C.K D.A1
2.下列碱金属中密度最小,熔沸点最高的是 ( A )
A.锂 B.钠 C.钾 D.铯
3.物质燃烧时,火焰呈紫色的一定含有 ( B )
A.钾原子 B.钾元素 C.钾离子 D.钾的化合物
4.做焰色反应时,使用的铂丝每次都要用试剂洗净,这种试剂指的是 ( C )
A.NaOH溶液 B.碳酸钠溶液 C.稀盐酸 D.硫酸溶液
5.将一小块金属钠放置在潮湿的空气中足够长的时间后,最终将转变为 ( C )
A.Na2O B.Na2O2 C.Na2CO3 D.NaOH
6.钠的下列用途与钠的化学性质无关的是 (BD )
A.用钠单质与氧气作用制取生氧剂Na2O2粉末
B.用钠、钾的合金作原子反应堆的导热剂
C.用钠冶炼第三代金属钛
D.应用于电光源上,如钠光灯
7.将CO2气体通入CaCl2溶液,若要有白色沉淀产生,应采用的方法是 ( D )
A. 通入少量的CO2 B.通入过量的CO2 C.加入盐酸 D.氢氧化钠溶液
8.鉴别碳酸钠和碳酸氢钠两种溶液,应采用的方法是 (B)
A.滴加盐酸 B.滴加氯化钙溶液 C.加热 D.滴加石灰水
9.下列说法中不正确的是 (CD)
A.欲除去CO2中混有的HCl气,需通入饱和的NaHCO3溶液中
B.H2中混有HCl气体,可通过NaOH溶液除去
C.欲除去CO中混有的CO2,可让混合气体通过Na2O2固体
D.CO2中混有SO2,可通过饱和Na2CO3溶液除去
10.(04年广东考)下列有碱金性铷(Rb)的叙述中,正确的是 (AB)
A.灼烧氯化铷时,火焰有特殊颜色
B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是弱碱
二、填空题
11. A、B、C是周期表中短周期元素间组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系:
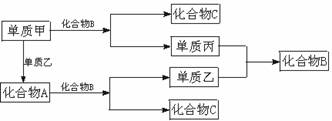
试完成下列空白:
(1)A、B、C的化学式分别为__________ 、__________、________ ;
(2)单质甲与化合物B反应的离子方程式为:____________________________;
(3)在A、B、C这三种化合物中,必定含有的元素是________.(用甲、乙、丙字母表示)
【答案】 (1)Na2O2 H2O NaOH(2)2Na+2H2O====2Na++2OH-+H2↑(3)乙
12.(2002年上海春季考题)铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。在鲜活鱼的长途运输中,必须考虑以下几点:水中需要保持适量的O2;及时除去鱼排出的CO2;防止细菌的大量繁殖。现有两种在水中能起供氧灭菌作用的物质,其性能如下:
过氧化钠(Na2O2):易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):微溶于水,与水反应生成Ca(OH)2(微溶)和O2。
根据以上介绍,你认为运输鲜活水产品时应选择 过氧化钙(或CaO2) 加入水中。原因是: Na2O2与水反应激烈,生成NaOH溶液的碱性太强(或CaO2在水中逐步溶解,与水缓慢反应不断提供O2)。(1分)(合理即给分)
13.(1997年上海高考题)某课外小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
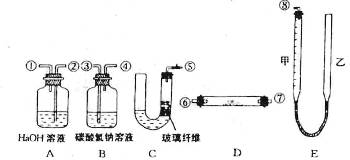
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0-50毫升),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试回答:
⑴上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):
⑵装置中放入的反应物是 和
⑶装置A的作用是 装置B的作用是
⑷为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数、求其差值的过程中,应注意 和 (填写字母编号) a视线与凹液面最低处相平 b等待片刻,待乙管中液面不再上升时,立刻读数 c读数时应上下移动乙管,使甲、乙两管液面相平 d读数时不一定使 甲、乙两管液面相平
答案:(1)⑤③④⑥⑦②①⑧(⑥⑦顺序可对调)(说明:错1 个即不给分) (2)大理石 盐酸 (3)吸收混在O2中未反应的CO2 吸收CO2中混有的HCl (4)a
三、计算题
14.某温度下Na2CO3和NaHCO3的溶解度分别为26.9 g和10 g,在此温度下,取100 g 饱和Na2CO3溶液,向其中通入过量的CO2,试求溶液中能析出固体多少克?
解答: 设100 g 饱和Na2CO3溶液中溶质Na2CO3的质量为m,则根据溶解度关系有:100:m=(100+26.9):26.9 m=21.2 g.
通入CO2后,发生反应:
Na2CO3+CO2+H2O====2NaHCO3
106 18 2×84
21.2 b a
从各物质的相互反应关系不难得出:生成NaHCO3的质量为33.6 g,反应消耗的水为3.6 g.此时溶液中的溶剂总质量为:100-21.2-3.6=75.2 g,依据NaHCO3的溶解度有:100 g:10 g=75.2 g:x
x=7.52 g,
则溶液中能析出NaHCO3的质量为33.6-7.52=26.08 g.
【答案】 26.08 g