![]()
|
|
学科: 化学 |
| 教学内容:第一章 化学反应及其能量变化第一节 氧化还原反应 |
本节学习目标:
1.用化合价变化和电子转移的观点加深对氧化、还原、氧化剂、还原剂等概念的理解.
2.学会用化合价的变化和电子转移的观点判断氧化还原反应.
3.理解氧化还原反应的实质.
4.初步学会利用“双线桥法”分析氧化还原反应.
5.学会氧化性,还原性的判断方法.
【重点难点解析】
1.重点是用化合价变化和电子转移的观点认识氧化、还原、氧化还原反应、氧化剂、还原剂等概念.
2.难点是氧化还原反应电子转移的表示方法——双线桥法;氧化性还原性能力的判断.
例1.下面有关氧化还原反应的叙述正确的是 ( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只作氧化剂
D.某元素从化合态变为游离态时,该元素一定被还原
E.金属原子失电子越多,其还原性越强
解析 灵活运用氧化还原反应的有关概念结合实例去分析.氧化还原反应的宏观特征是元素化合价有升降,但不一定是所有元素化合价均有升降.如Fe2O3+3CO=2Fe+3CO2,碳元素没有化合价变化.故A正确.化合价变化的元素可能是不同种元素,也可以是同种元素.如Cl2+2NaOH=NaCl+NaClO+H2O,故B不正确.作为非金属在反应中一般作为氧化剂,但也有失电子的可能:如C+O2![]() CO2,故C不正确.从化合态变为游离态分两种情况:一是从高价态变为游离态如Fe2+→Fe,化合价降低,得电子,被还原.另一种是从低价态变为游离态如Cl-→Cl2,化合价升高,失电子,被氧化,故D不正确.金属具有还原性,还原性指失电子能力的强弱,而不是失电子数越多,还原性越强.例如Na与Al均与氧化剂反应,一般Na只失一个电子,但非常容易,Al失三个电子,但比Na困难,故还原性Na>Al,答案E不正确.
CO2,故C不正确.从化合态变为游离态分两种情况:一是从高价态变为游离态如Fe2+→Fe,化合价降低,得电子,被还原.另一种是从低价态变为游离态如Cl-→Cl2,化合价升高,失电子,被氧化,故D不正确.金属具有还原性,还原性指失电子能力的强弱,而不是失电子数越多,还原性越强.例如Na与Al均与氧化剂反应,一般Na只失一个电子,但非常容易,Al失三个电子,但比Na困难,故还原性Na>Al,答案E不正确.
例2.下列反应中,属于氧化还原反应的是( )
A.CaCO3+2HCl![]() CaCl2+CO2↑+H2O B.CaO+H2O
CaCl2+CO2↑+H2O B.CaO+H2O![]() Ca(OH)2
Ca(OH)2
C.Fe+CuSO4![]() FeSO4+Cu D.
FeSO4+Cu D. ![]() ↑
↑
解析 判断一个反应是否为氧化还原反应,必须抓住它的特征,看元素的化合价是否发生改变.若改变,则为氧化还原反应.反之,则为非氧化还原反应.本题只有C中铁和铜的元素化合价发生了改变,故答案为C.
例3.氧化还原反应与电子转移之间有什么关系?
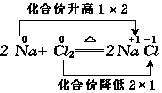
(1)以反应2Na+Cl2![]() 2NaCl为例分析:
2NaCl为例分析:
在Na与Cl2反应前后,元素化合价的升降情况为
元素原子之间得失电子情况为
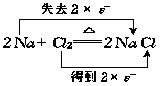
由此可知,在由单质Na和Cl2生成离子化合物NaCl的反应里,元素化合价的升降与元素原子之间的电子转移之间有着密切关系.元素原子失去(或得到)电子,元素的化合价就升高(或下降),并且元素原子失去(或得到)的电子数与元素化合价升高(或降低)的数相等.电子得失,属于电子转移.
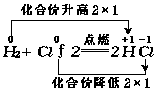
(2)以反应H2+Cl2![]() 2HCl为例分析
2HCl为例分析
在H2与Cl2反应前后,元素化合价的升降情况为
元素原子之间电子偏移情况为:
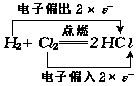
由上可知,在像由单质H2和Cl2生成共价化合物HCl的反应里,元素化合价的升降与元素原子之间的共用电子对的偏移有着密切关系.共用电子对偏出(或偏入),元素的化合价就升高(或降低),并且元素原子偏出(或偏入)的电子数与元素化合价升高(或降低)的数相等.电子偏出偏入,也属于电子转移.
(3)综上结论可知,元素化合价的升降既与氧化还原反应之间有着密切的关系,又与元素原子之间的电子转移有密切关系.物质失去电子的反应是氧化反应,物质得到电子的反应是还原反应,凡是有电子转移(得失或偏移)的反应都是氧化还原反应.
【难题巧解点拨】
例1 在下列反应中,水作还原剂的是( )
A.SO3+H2O=H2SO4 B.2Na+2H2O=2NaOH+H2↑
C.2H2+O2![]() 2H2O D.2F2+2H2O=4HF+O2
2H2O D.2F2+2H2O=4HF+O2
解析 (1)看价态是否有变化排除非氧化还原反应(A) (2)氧化剂还原剂指的是反应物排除(C) (3)据化合价“升—失—氧(被)—还(剂)得 (D)项符合题意.
例2 根据下列反应判断有关的物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
解析 (1)先确定好每个反应中的还原剂与还原产物 (2)利用规律:还原性为还原剂强于还原产物,有:H2SO3>HI,HI>FeCl2,FeCl2>NO 得答案为(A)选项.
考试热点:
【命题趋势分析】
本节是历届高考的重点,围绕电子转移等知识的考查,实质是检验学生对氧化还原反应基本原理的理解程度.题型以选择题、填空题为主,考查范围涉及到所有元素及化合物,甚至从未见过的化合物,并且常常结合其他理论知识点一同检验,增加难度.
【典型热点考题】
例1 G、Q、X、Y、Z均为氯的含氧化合物.我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
①G→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
分析 根据氧化还原反应中元素化合价升降总数相等这一规律.对于反应,G→NaCl变化中,Cl的化合价降低,则G→Q变化中Cl的化合价必然升高,亦即氯的化合价:G![]() Q;同理,由②可判断氯的化合价:X>Q;由③并结合Q>G可判断氯的化合价:Q>Y>G;由④并结合X>Q可判断氯的化合价:X>Z>Q,综合之,答案为(B).
Q;同理,由②可判断氯的化合价:X>Q;由③并结合Q>G可判断氯的化合价:Q>Y>G;由④并结合X>Q可判断氯的化合价:X>Z>Q,综合之,答案为(B).
例2 根据下列反应判断有关物质还原性由强到弱的顺序是(1998年上海高考题)( )
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
解析 这是利用氧化还原反应方程式比较不同还原剂还原性强弱的题目,比较原则是:还原剂还原性>还原产物还原性.本题关键是判断每个反应的还原剂和还原产物.判断结果是还原性H2SO3>I-,I->Fe2+,Fe2+>NO.答案应选A.
例3 某强氧化剂XO(OH)2+被亚硫酸钠还原到较低价态,对于24个XO(OH)2+离子需用含60个SO32-离子的溶液,那么X元素的最终价态为 .(西安市检测题)
解析 由题意分析知,Na2SO3作还原剂时,只能由SO32-转化为SO42-,每个SO32-应失去2个电子,60个SO32-就会失去120个电子,而对于24个XO(OH)2+离子来说,正好应对120个电子,若设每个XO(OH)2+离子在反应中应得n个电子,则有:24n=60×2,解之得n=5.
由于X元素在XO(OH)2+中显示+5价,所以当其每个离子得5个电子而降低5价时,应使X元素的最终价态为0价.即答案:0价.
类似确定元素的化合价、确定物质的化学式等问题,应抓住得失电子相等的守恒规律.
例4 下列反应中,属于非氧化还原反应的是( )
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O D.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
解析 判断一个反应是否为氧化还原反应,必须抓住它的特征,看是否有元素的化合价发生改变.若有改变,则为氧化还原反应,反之,则为非氧化还原反应,本题D中元素化合价没有改变,答案D.
类似确定元素的化合价、确定物质的化学式等问题,应抓住得失电子相等的守恒规律.
例5 高锰酸钾和氢溴酸溶液,可以发生下列反应:KMnO4+HBr=Br2+MnBr2+KBr+H2O,其中还原剂是 ,若消耗158g氧化剂,则被氧化的还原剂的质量是 g.
解析 本题考查配平及有关计算,根据化合价变化可知KMnO4为氧化剂,HBr为还原剂.根据化合价升降总数相等,KMnO4与被还原HBr的关系为2KMnO4—10HBr,经计算40.5gHBr被还原.故答案为HBr,40.5g.
例6 氢化钙(CaH2)可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,下列说法不正确的是( )
A.CaH2既是还原剂,又是氧化剂. B.H2既是氧化产物,又是还原产物.
C.CaH2是还原剂,H2O是氧化剂. D.氧化产物与还原产物质量比为1∶1.
解析 此题的关键是分析判断出CaH2中氢元素的化合价为-1价.(因金属元素钙不可能有负价态,在化合物中钙元素只有+2价).答案为A.

【同步达纲练习】
1.下列说法中错误的是( )
A.凡是氧化还原反应,都不可能是复分解反应
B.化合反应不可能是氧化还原反应
C.置换反应一定是氧化还原反应
D.分解反应可能是氧化还原反应
2.已知在某温度时发生如下三个反应:
(1)C+CO2=2CO (2)C+H2O=CO+H2 (3)CO+H2O=CO2+H2
由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是( )
A.CO>C>H2 B.C>CO>H2 C.C>H2>CO D.CO>H2>C
3.在2H2S+SO2=3S+2H2O的反应中,还原产物和氧化产物的质量比是( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
4.下列叙述正确的是( )
A.元素的单质可由氧化或还原含该元素的化合物来制得.
B.得电子越多的氧化剂,其氧化性就越强.
C.阳离子只能得电子被还原,只能作氧化剂.
D.含有最高价元素的化合物不一定具有强氧化性.
5.下列变化中,一定需加还原剂才能实现的是( )
A.Cl2→Cl- B.FeCl3→FeCl2 C.C→CO2 D.KMnO4→MnO2
6.下列物质属于常见氧化剂一组的是( )
A.Cl2、O2、FeCl3、KMnO4 B.O2、KMnO4、C、H2
C.Na、K、FeCl2、H2、CO D.CuO、CO、Fe2O3、H2
7.下列反应中,反应物中各元素都参加氧化还原反应的是( )
A.2HgO![]() 2Hg+O2↑ B.CuO+H2
2Hg+O2↑ B.CuO+H2![]() Cu+H2O
Cu+H2O
C.2AgNO3![]() 2Ag+2NO↑+O2↑ D.Cl2+2NaOH=NaCl+NaClO+H2O
2Ag+2NO↑+O2↑ D.Cl2+2NaOH=NaCl+NaClO+H2O
8.同种元素的同一价态,部分被氧化,部分被还原的反应是( )
A.3Br2+6KOH=5KBr+KBrO3+3H2O B.NH4NO3![]() N2O+2H2O
N2O+2H2O
C.3NO2+H2O=2HNO3+NO D.2KNO3![]() 2KNO2+O2↑
2KNO2+O2↑
9.下列叙述中,正确的是( )
A.含氧酸能起氧化作用,无氧酸则不能
B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获电子能力一定强
D.由x变为x2+的化学反应是氧化反应
10.在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,若有64gCu被氧化,则被还原的HNO3的质量是( )
A.168g B.42g C.126g D.60g
11.判断下列反应是否属于氧化还原反应,用双线桥表示出氧化还原反应中电子转移情况,并指明氧化剂与还原剂:
(1)2KClO3![]() 2KCl+3O2↑ (2)2KMnO4
2KCl+3O2↑ (2)2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)2NaOH+CO2=Na2CO3+H2O (4)Zn+CuSO4=ZnSO4+Cu
(5)CaCO3+H2O+CO2=Ca(HCO3)2 (6)Fe2O3+3CO![]() 2Fe+3CO2↑
2Fe+3CO2↑
12.已知下列反应:
①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2
③Cl2+H2O=HCl+HclO ④2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
⑤CaO+H2O=Ca(OH)2 ⑥CaCO3+H2O=Ca(HCO3)2
(1)其中水在反应中作氧化剂的反应是(填代号下同) .
(2)其中水在反应中作还原剂的反应是 .
(3)其中水在反应中既不作氧化剂也不作还原剂的反应是 .
13.在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 是还原剂; 元素被氧化; 元素被还原; 是氧化产物; 是还原产物;电子转移的总数是 .
14.判断下列说法是否正确,正确的在题后括号中画“√”,错误的画“×”.
(1)在氧化还原反应中,氧化剂失电子总数一定等于还原剂得的电子总数.( )
(2)金属单质在化学反应中,因为失电子,所以常作还原剂.( )
(3)任何一种元素由化合态度为游离时的反应都是发生氧化反应.( )
(4)凡是含有易被氧化的元素,一定是还原剂.( )
【素质优化训练】
1.下列金属中,还原性最强的是( )
A.Au B.Fe C.Na D.Mg
2.黑火药发生爆炸的反应如下:
2KNO3+S+3C=K2S+N2↑+3CO2↑被还原的元素是( )
A.氮 B.碳 C.氮和碳 D.氮和硫
3.根据反应(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=+Cu2++2Fe2+ (3)2Fe2++Cl2=2Fe3++2Cl- (4)HClO+H++Cl-=H2O+Cl2,可以判断出各粒子的氧化性由强到弱的顺序正确的是( )
A.HClO>Cl2>Fe3+>Cu2+ B.Cl2>HClO>Fe3+>Cu2+
C.Cl2>Fe3+>HClO>Cu2+ D.HClO>Cl2>Cu2+>Fe3+
4.在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数比( )
A.1∶2 B.2∶1 C.1∶1 D.3∶2
5.已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2 B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaZ+Y2 D.2NaZ+X2=2NaX+Z2
6.R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2On-离子变为RO42-离子,又知反应中氧化剂与还原剂的离子数之比为5∶2,则n的值是( )
A.1 B.2 C.3 D.4
7.高锰酸钾和氢溴酸溶液可以发生下列反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8
H2O,其中氧化剂是 .若消耗15.8g氧化剂,则被氧化的还原剂的质量是 g.

答案:
【同步达纲练习】
1.B 2.D 3.C 4.A、D 5.B 6.A 7.AC 8.AC 9.D 10.B
11.(是)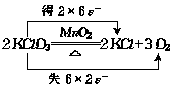
KClO3既是氧化剂,又是还原剂
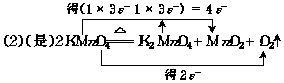
(3)(非)
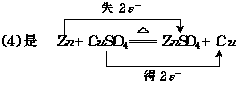
Zn是还原剂 CuSO4是氧化剂.
(5)非
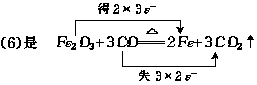
Fe2O3是氧化剂 CO是还原剂
12.(1)①④(2)②(3)③⑤⑥
13.K2Cr2O7、HCl 氯、铬、Cl2、CrCl3、6.14.1× 2√ 3× 4×
【素质优化训练】
1.C 2.D 3.A 4.A 5.B、C 6.B 7.HBr,40.5 8.Pbs+4H2O=PbSO4+4H2O,氧化8
