高一实验班专题影响化学平衡移动的因素
1、对于反应2SO2+O2![]() 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A、2体积SO2与足量O2反应,必定生成2体积SO3 B、其它条件不变,增大压强,平衡必定向右移动![]()
C、平衡时,SO2消耗速率必定等于O2生成速率的两倍 D、平衡时,SO2浓度必定等于O2浓度的两倍
2、已建立平衡的某可逆反应,当改变条件使化学平衡向正反应移动时,下列叙述正确的是: ①生成物的体积分数一定增加;②生成物的产量一定增加;③反应物的转化率一定增加;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥使用了合适的催化剂
A.①② B.②⑤ C.③⑤ D.④⑥
3、对已达化学平衡的下列反应2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A.逆反应速率增大正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动 D.正、逆反应速率都增大,平衡向正反应方向移动
![]() 4.往一真空密闭容器中通入一定量的气体A,在一定条件下,发生如下反应: 2A(g) B(g)+xC(g),反应达平衡时,测得容器内压强增大了p%,若此时A的转化率为a%,下列关系正确的是
4.往一真空密闭容器中通入一定量的气体A,在一定条件下,发生如下反应: 2A(g) B(g)+xC(g),反应达平衡时,测得容器内压强增大了p%,若此时A的转化率为a%,下列关系正确的是
A.若x=1,则p>a B.若x=2,则p<a C.若x=3,则p=a D.若x=4,则p≥a
5.现有3个体积相同的密闭容器,都进行下列反应:CO2+H2![]() H2O(气)+CO,反应所处的温度相同,但起始的物质的量不同,其中甲:CO2=H2=amol,乙:CO2=amol,H2=2amol。丙:CO2=H2=H2O(气)=amol。达到平衡时,CO的物质的量由大到小的顺序是
H2O(气)+CO,反应所处的温度相同,但起始的物质的量不同,其中甲:CO2=H2=amol,乙:CO2=amol,H2=2amol。丙:CO2=H2=H2O(气)=amol。达到平衡时,CO的物质的量由大到小的顺序是
 A.甲>乙>丙 B.甲>丙>乙
C.乙>丙>甲
D.乙>甲>丙
A.甲>乙>丙 B.甲>丙>乙
C.乙>丙>甲
D.乙>甲>丙
6.有两个极易导热的密闭容器a和b(如图6-1所示),a容器体积恒定,b容器体积可变,压强不变。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2![]() N2O4
+Q,则以下说法正确的是:
N2O4
+Q,则以下说法正确的是:
A.反应起始时两容器的反应速率va和vb的关系: va<vb
B.反应过程中两容器内的反应速率va和vb的关系: va<vb
C.两容器内反应达到平衡所需用的时间一定相同 D.反应达到平衡,两容器的NO2的转化率相同
7.将颜色相近的NO2和Br2(g)分别装入注射器中,将活塞同时向外拉使气体体积扩大一倍,颜色变化不符合叙述的是:
A.Br2(g)颜色比NO2深 B.NO2颜色比Br2(g)深 C.两种颜色一样 D.两种颜色均比原来浅
8.在一密闭容器中,反应mA(g) ![]() nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则:
nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则:
A.平衡向逆反应方向移动了 B.物质A的转化率增加了 C.物质C的质量分数增加了 D. m<2n
9.某温度下,反应H2(g)+I2(g) ![]() 2HI(g);△H>0(正反应为吸热反应)。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是
2HI(g);△H>0(正反应为吸热反应)。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是
A.恒温,压缩体积,平衡不移动,混合气体颜色加深 B.恒压,充入HI(g),开始时逆反应速率变大
C.恒容,升高温度,正反应速率减小 D.恒容,充入H2,I2(g)的体积分数降低
10、在甲容器中盛入2 mol SO3,乙容器中加入2 mol SO2和1 mol O2,假定反应前两容器的容积相等。反应开始后甲容器保持体积不变,乙容器保持压强不变,在相同条件(500℃,催化剂)下均达到平衡时,甲与乙容器内压强的关系是:
A.甲大于乙 B.甲小于乙 C.甲等于乙 D.无法确定
11.化学反应C(s)+H2O(g) ![]() CO(g)+H2(g)-Q达到平衡,下列叙述正确的是:
CO(g)+H2(g)-Q达到平衡,下列叙述正确的是:
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.加入固体炭,平衡向正反应方向移动 C.加入水蒸气使容器内压强增大,平衡向逆反应方向移动
D.扩大容器的容积,平衡向正反应方向移动
12.可逆反应:3A(气)![]() 3B(?)+C(?)-Q,随着温度升高气体平均相对分子质量有变小趋势,则下列判断正确的是
3B(?)+C(?)-Q,随着温度升高气体平均相对分子质量有变小趋势,则下列判断正确的是
A .B和C可能都是固体 B.B和C一定都是气体 C.若B为固体,则C一定是气体 D.B和C可能都是气体
 13.某固定体积的密闭容器中存在化学平衡:a A(气)
13.某固定体积的密闭容器中存在化学平衡:a A(气) ![]() b B(气)+c C(气),在温度不变的体积下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是:
b B(气)+c C(气),在温度不变的体积下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是:
A.若a=b+c时,B的物质的量分数不变 B. 若a=b+c时,B的物质的量分数变大
C.若a>b+c时,A的转化率不变 D. 若a<b+c时,A的转化率变大
14.乙酸蒸气能形成二聚分子: 2CH3COOH(气)![]() (CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是:
(CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是:
A.低温高压 B.高温低压 C.低温低压 D.高温高压
 15.反应 X(气)+ Y(气)
15.反应 X(气)+ Y(气) ![]() 2Z(气)+ Q(Q>0), 在一定条件下,反应物Y的转化率与反应时间(t)的关系如右图所示。若使曲线a变为曲线b可采取的措施是: A.加入催化剂 B.降低温度 C.增大压强 D.增大Y的浓度
2Z(气)+ Q(Q>0), 在一定条件下,反应物Y的转化率与反应时间(t)的关系如右图所示。若使曲线a变为曲线b可采取的措施是: A.加入催化剂 B.降低温度 C.增大压强 D.增大Y的浓度
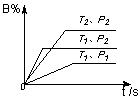
16.已知某可逆反应m A(g)+n B(气)![]() p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是:
p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是:
A.T1<T2,P1>P2,m+n>p,Q>0 B. T1>T2,P1<P2,m+n>p,Q<0
C.T1<T2,P1>P2,m+n<p,Q>0 D. T1>T2,P1<P2,m+n<p,Q<0
17、在注射器内吸入NO2与N2O4的混合气体,将出口处封闭,若向内突然推进活塞,会发现筒内气体颜色立即变__深___,然后又慢慢变__浅__;若向外突然拉动活塞,会发现筒内气体颜色立即变_____浅___,然后又慢慢变___深___,该反应的化学方程式为__2NO2![]() N2O4___,这说明增大压强平衡向_气体体积缩小的方向移动__。在突然推拉的短暂时间内气体颜色的突然变化是因为气体的__浓度__变化所致。
N2O4___,这说明增大压强平衡向_气体体积缩小的方向移动__。在突然推拉的短暂时间内气体颜色的突然变化是因为气体的__浓度__变化所致。
18、在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 m+n<p 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 非气态 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 向逆反应方向移动 。
19.在100℃时,将0.1mol的四氧化二氮气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:试填空:
| 时间 浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式__ N2O4
![]() _2NO2_____________;达到平衡时四氧化二氮的转化率为____60%______。表中c2__>___c3__=___a__=____b(选填“>”、“<”、“=”)。
_2NO2_____________;达到平衡时四氧化二氮的转化率为____60%______。表中c2__>___c3__=___a__=____b(选填“>”、“<”、“=”)。
(2)20s时四氧化二氮的浓度c1=__0.07_mol·L-1 ,在0s~20s内四氧化二氮的平均反应速率为__0.0015____mol·(L·s)-1。
![]() (3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____0.2____ mol·L-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____0.2____ mol·L-1。
20.在10℃和4×105Pa的条件下,当反应aA(g) dD(g) + eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后,物质D的浓度见下表(在增大压强的过程中无其它副反应发生):
| 压强(Pa) | 4×105 | 6×105 | 1×106 | 2×106 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
(1)压强从4×105 Pa增加到6×105 Pa时平衡应向 逆 反应方向移动(填“正”或 “逆”),理由是 略 。
(2)压强从1×106 Pa 增加到2×106 Pa时,平衡向 正 反应方向移动(填“正”或 “逆”).理由是 略 。
 21.在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生以下反应: N2+3H2
21.在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生以下反应: N2+3H2 ![]() 2NH3+Q若反应达到平衡后,测得混合气体为7体积。据此回答下列问题:
2NH3+Q若反应达到平衡后,测得混合气体为7体积。据此回答下列问题:
(1)保持上述温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积分数仍与上述平衡时完全相同。那么:①若a=1,c=2,则b=___3________,在此情况下,反应起始时将向_____逆______方向进行(填“正”或“逆”)。②若需规定起始时,反应向逆方向进行,则c的范围是__1<C<=4_______。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_降温__________,原因是___略___。
22.将等物质的量的A、B、C、D四种物质混和,发生如下反应:aA+bB![]() cC(固)+dD当反应进行一定时间后,测得A减少了n摩,B减少了
cC(固)+dD当反应进行一定时间后,测得A减少了n摩,B减少了![]() n摩,C增加了
n摩,C增加了![]() n 摩,D增加了n摩,此时达到化学平衡:
n 摩,D增加了n摩,此时达到化学平衡:
(1)该化学方程式中各物质的系数为: a= 2 、b= 1 、 c= 3 、d= 2
(2)若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态: A 气 B 非气 D 气
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为 放热反应(填“放热”或“吸热”)。
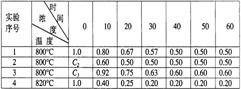 23.某化学反应2A
23.某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:根据上述数据,完成下列填空:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 0.013 mol/(L·min)。
(2)在实验2,A的初始浓度C2= 1.0 mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是使用催化剂 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 > V1(填>、=、<=,且C3 > 1.0mol/L(填>、=、<=(4)比较实验4和实验1,可推测该反应是 吸热 反应(选填吸热、放热)。理由是略