高一下化学期末练习化学高考题集锦
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象A.![]()
![]()
![]() B.
B.![]()
![]()
![]()
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
2. 在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入![]() 该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )
该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
3.能与人体血液中血红蛋白结合的一种有毒气体是A.氯气B.氮气C.一氧化碳D.甲烷
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是A.Al3+ B.Mg2+ C.Be2+ D.H+
5.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是A.Ds原子的电子层数为7 B.Ds是超铀元素 C.Ds原子的质量数为110 D.Ds为金属元素
6.下列说法中不正确的是A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1 C.32g氧气所含的原子数目为2×6.02×1023 D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
7.下列产品的使用不会对环境造成污染的是A含磷洗衣粉B酒精C氟里昂D含汞电池
8.下列物质中属于离子化合物的是A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
9.据报道,月球上有大量3He存在,以下关于3He的说法正确的是A.是4He的同分异构体B.比4He多一个中子C.是4He的同位素D.比4He少一个质子
10.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是A.Mg B. Cu C. Ag D. H2
11.下列物质中不会因见光而分解的是A.NaHCO3 B.HNO3 C.AgI D.HClO
12.有关晶体的下列说法中正确的是A晶体中分子间作用力越大,分子越稳定B原子晶体中共价键越强,熔点越高C冰熔化时水分子中共价键发生断裂D氯化钠熔化时离子键未被破坏
13.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是A.将两种样品分别溶于硝酸,区别所产生的气体B.将两种样品分别溶于硝酸,区别溶液的颜色C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
14.下列两种气体的分子数一定相等的是A.质量相等、密度不等的N2和C2H4
B.等体积等密度的CO和C2H4 C.等温等体积的O2和N2 D.等压等体积的N2和CO2
15.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
16.下列各组物质中,互为同位素的
A重氢、超重氢 B氧、臭氧 C红磷、白磷 D乙酸、丙酸
17.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是A.NO分子中有极性共价键B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
18.下列有关溶液性质的叙述,正确的是A室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体 B.20℃,100g水可溶解34.2g KCl,此时KCl 饱和溶液的质量分数为34.2% C.强电解质在水中溶解度一定大于弱电解质 D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
19.下列叙述正确的是A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质C.核外电子总数相同的原子,一定是同种元素的原子D.能与酸反应的氧化物,一定是碱性氧化物
|
21.强热硫酸亚铁固体可发生如下反应2FeSO4 Fe2O3
+SO2↓+SO3↑若将此反应生成的气体通入BaCl2溶液中则A析出BaSO3沉淀B析出BaSO4沉淀C逸出SO3气体D逸出SO2气体
22.科研人员最近发现放射性同位素钬16667Ho可有效地治疗肝癌.该同位素原子核内的中子数为A.99 B.67 C.166 D.233
23.酸雨有很大的危害.下列气体在空气中达到一定含量时,可形成酸雨的是
A.NH3 B.CO C.H2 D.SO2
24.下列实验操作中,正确的是(b)A.称量固体药品时,将药品直接放在天平托盘上
B.实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 C.先将pH试纸用蒸馏水润湿后,再测定溶液的pH D.在量筒中稀释浓硫酸
25.配制500mL 2mol/LNaOH溶液所需NaOH的质量为A.80g B.20g C.50g D.40g
26.下列实验操作中,正确的是A.称量固体药品时,将药品直接放在天平托盘上
B.实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
C.先将pH试纸用蒸馏水润湿后,再测定溶液的pH D.在量筒中稀释浓硫酸
27. X、y、Z均为短周期元素,它们的原子核外最外层电子数依次为l、6、6,Z位于Y的上一周期,则X、Y、Z三种元素形成的某种化合物的化学式可能为
A.X2YZ4 B.XY2Z3 C.X3YZ4 D.X3YZ3
28.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氮元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氮元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.![]() 原子核内含有4个质子 D.
原子核内含有4个质子 D.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子 D.
原子核内含有3个中子 D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
29.下列各项中表达正确的是
A.F—的结构示意图:![]() B.CO2的分子模型示意图:
B.CO2的分子模型示意图:
C.NaCl的电子式:![]() D.N2的结构式: :N≡N:
D.N2的结构式: :N≡N:
30. 2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质B.大量开采地下水,以满足社会对水的需求 C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃 D.节约能源,提高能源利用率
31.下列关于浓硫酸的叙述正确的是A浓硫酸具有吸水性,因而能使蔗糖炭化 B浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体c浓硫酸是一种干燥剂,能够干燥氨气氢气等气体 D浓硫酸在常温下能够使铁、铝等金属钝化
32. X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
33、下列离子方程式正确的是A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.钠与水反应Na+2H2O=Na++2OH-+H2↑ C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
34、取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加ag。下列物质中不能满足上述结果的是
A.H2 B.CO C.C6H12O6 D.C12H22O11
35.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是A.由二氧化碳合成金刚石是化学变化B.金刚石是碳的一种同位素C.钠被氧化最终生成碳酸钠D.金刚石中只含有非极性共价键
36.下列指定微粒的个数比为2:1的是A.![]() 离子中的质子和电子B.
离子中的质子和电子B.![]() 原子中的中子和质子C.
原子中的中子和质子C.![]() 晶体中的阳离子和阴离子D.
晶体中的阳离子和阴离子D.![]() (过氧化钡)固体中的阴离子和阳离子
(过氧化钡)固体中的阴离子和阳离子
37.用![]() 表示阿伏加德罗常数,下列叙述中正确的是A. 0.1
表示阿伏加德罗常数,下列叙述中正确的是A. 0.1![]() 稀硫酸100mL中含有硫酸根个数为0.1
稀硫酸100mL中含有硫酸根个数为0.1![]() B.
1mol
B.
1mol![]() (碳正离子)中含有电子数为10
(碳正离子)中含有电子数为10![]()
C.2.4g金属镁与足量的盐酸反应,转移电子数为2![]() D.12.4g白磷中含有磷原子数为0.4
D.12.4g白磷中含有磷原子数为0.4![]()
38.从矿物学资料查得,一定条件下自然界存在如下反应:
![]() ,下列说法正确的是
,下列说法正确的是
A. Cu2S既是氧化产物又是还原产物B. 5mol FeS2发生反应,有10mol电子转移
C. 产物中的![]() 离子有一部分是氧化产物D. FeS2只作还原剂
离子有一部分是氧化产物D. FeS2只作还原剂
39. 20℃时,饱和KCl溶液的密度为![]() ,物质的量浓度为
,物质的量浓度为![]() ,则下列说法中不正确的是A. 25℃时,饱和KCl溶液的浓度大于
,则下列说法中不正确的是A. 25℃时,饱和KCl溶液的浓度大于![]() B. 此溶液中KCl的质量分数为
B. 此溶液中KCl的质量分数为![]() C.
20℃时,密度小于
C.
20℃时,密度小于![]() 的KCl溶液是不饱和溶液 D. 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于
的KCl溶液是不饱和溶液 D. 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于![]()
40.(15分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:![]() (气),
(气),![]() (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
<1>Y的化学式是_________;
<2>生成固体C的化学方程式是_______________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
<1>B的化学式是__________;
<2>向苛性钠溶液中通入过量的A,所发生反应的离子方程式是__________________________;
<3>将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是______________。
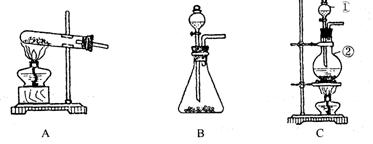 41. (9分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
41. (9分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
(1)选用A装置可制取的气体有________________选用B装置可制取的气体有________________通常选用C装置制取的气体有______
(2)标号①、②的仪器名称依次为_______ ,________________
(3)写出利用上述有关药品制取氨气的化学方程式: ______________
若要制得干燥的氨气,可选用下列干燥剂中的________________(填序号)
a.生石灰 b,浓硫酸 C.三五氧化二磷
42. (5分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:(1)反应后生成硫酸铜的物质的量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
43. (10分)请按要求填空:(1)用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、蒸发、结晶、 。
(3)除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式): 。
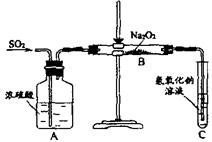 44. (12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
44. (12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:


![]()
![]()

上述方案是否合理? 。请简要说明两点理由:
① ;② 。
45. (6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 、 。
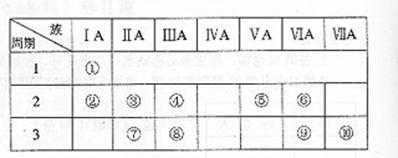 46.右表是元素周期表的一部分。
46.右表是元素周期表的一部分。
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
1C 2 A 3 C 4 B 5 C 6 D 7 B 8 A 9 C 10 C
11 A 12 B 13C 14 AB 15 C 16A 17D 18D 19C 20D
21BD 22A 23D 24B 25D 26B 27A 28B 29A 30B
31D 32 C 33D 34D 35 B 36 A 37D 38C 39D
40 (1)<1>H2 <2>![]()
(2)<1>SO2
<2>![]()
<3>![]()
41 (共9分)(1)NH3;H2、CO2、Cl2(共4分,每种气体1分)(2)分液漏斗 圆底烧瓶
(共2分,每空1分)(3)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O(2分)a(1分)
42 (共5分)
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)
1mol 22.4L
n(CuSO4) 22.4L
1mol:n(CuSO4)=22.4L:2.24L
n(CuSO4)=0.1mol (2分)
(2)c(CuSO4)=0.1mol/0.5L=0.2mol/L (1分)
43 (10分) ⑴100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管
⑵溶解 过滤 (3)BaCl2[或Ba(OH)2]、K2CO3、HCl
44 (12分)(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
45 (6分)(1)N2 CO; CO2 N2O (2)SO2、 O3
46 (1)HCl 弱 (2)N (3)H、O、S
(4)Be(OH)2+2NaOH → Na2BeO2+2H2O Li