高一新生化学试卷
原子量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27
S:32 Cl:35.5 Ca:40 Cu:64 Zn:65 Fe:56
一、选择题(每小题只有1个选项符合题意)
1、目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及( )
A、SO2 B、NO2 C、CO2 D、可吸入颗粒物
2、2004年4月25日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展。”下列行为中不符合这一主题是( )
A、采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B、大量开采地下水,以满足社会对水的需求
C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D、节约能源,提高能源利用率
3、当下列物质:①大理石 ②钟乳石 ③锅垢 ④贝壳 ⑤蛋壳,分别滴加醋酸时,会产生相同气体的( )
A、只有①② B、只有④⑤ C、只有①②③ D、是①②③④⑤
4、下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A、Al3+ B、Mg2+ C、Be2+ D、H+
5、2003年10月16日6时23分,“神舟”五号载人飞船在内蒙古成功着陆,返回舱完好无损。飞船在重返大气层时,由于同空气的剧烈磨擦,船体的表面温度将上升到2000℃~3000℃,因此飞船表面必须有良好的防高温措施。下列有关飞船的防高温措施中不可取的是( )
A、使用陶瓷类的贴面覆盖船体,以防止高温侵入舱内
B、使用在一定条件下能熔化或气化的表面覆盖材料
C、使用在一定条件下能与大气层中的氧气发生剧烈燃烧的表面覆盖材料
D、使用在一定条件下能发生分解反应的表面覆盖材料
6、两位美国科学家彼得·阿格雷和罗德里克·麦金农,因为发现细胞膜水通道,以及对离子通道结构和机理研究作出的开创性贡献而获得2003年诺贝尔化学奖。他们之所以获得诺贝尔化学奖而不是生理学或医学奖是因为( )
A、他们的研究和化学物质水有关
B、他们的研究有利于研制针对一些神经系统疾病和心血管疾病的药物
C、他们的研究深入到分子、原子的层次
D、他们的研究深入到细胞的层次
7、用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是( )
A、FeO B、Fe2O3 C、CuO D、Cu2O
8、某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是( )
A、沉淀物的质量为5.6g B、沉淀物的质量为7.4g
C、饱和石灰水的质量大于98.2g D、饱和石灰水的质量小于98.2g
9、某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g。若向此溶液中添加3.5g氯化钠和6.5g水,则所得溶液的的溶质质量分数是( )
A、30% B、![]() C、26.5% D、
C、26.5% D、![]()
10、在19世纪,化学家对氧化锆的化学式有争议。经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233。若氧化锆中锆的化合价与氯化物中的相同,试判断氧化锆的化学式为( )
A、ZrO2 B、Zr2O C、Zr2O3 D、ZrO
11、将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将bg(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
12、现有一种物质分子的模型如右图。则下列说法正确的是( )
A、该物质不是有机物
B、该物质的化学式是C2H6O
C、该物质不是可燃物
D、大量饮用该物质对人体有益
13、a、b、c三种物质的溶解度曲线如右下图所示。现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
A、c溶液中有晶体析出
B、a、b溶液均为不饱和溶液
C、c溶液中的溶质质量分数最小
D、a溶液中的溶质质量分数最大
14、甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
A、甲一定是氢氧化钙溶液 B、乙一定是硝酸钾溶液
C、丙不可能是碳酸钠溶液 D、丁只能是盐酸
15、将一定量铝粉和氧化铜混合加热,反应的化学方程式为![]() 。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是( )
。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是( )
①加入稀硫酸后,有气泡生成
②加入稀硫酸后,没有气泡生成
③加入稀硫酸后,溶液中有红色不溶物质
④插入溶液中的铁片表面有红色物质析出
A、只有④ B、②③ C、③④ D、①③④
二、选择题(每小题有1个或2个选项符合题意)
16、若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是( )
A、将金粉和铜粉混合 B、将牛奶加入水中混合
C、将氯化钠晶体溶于水中 D、用漏斗、滤纸过滤除去水中的泥沙
17、金属X、Y、Z分别是Fe、Al、Cu、Ag中的一种。其中X能与稀H2SO4反应生成X2(SO4)3,而Y、Z不能与稀H2SO4反应;Y能与AgNO3溶液反应,而Z不能与AgNO3溶液反应。则X、Y、Z依次为( )
A、Fe、Ag、Cu B、Fe、Cu、Ag
C、Al、Cu、Ag D、Al、Ag、Cu
18、为了防止煤气逸散使人中毒,常在煤气中加入少量的有特殊气味的乙硫醇(C2H5SH)。乙硫醇在煤气燃烧过程中也可充分燃烧。其化学方程式为![]() 则X的化学式为( )
则X的化学式为( )
A、H2SO4 B、SO3 C、SO2 D、CO
19、“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%。在用C3H4(丙块)合成C5H8O2(2—甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是( )
A、CO和CH3OH B、CO2和H2O C、H2和CO D、CH3OH和H2
20、将一严重锈蚀而部分变成铜绿[Cu2(OH)2CO3]的铜块研磨成粉末,在空气中充分灼烧成CuO,固体质量的变化情况可能是( )
A、增重30% B、增重10% C、不变 D、减轻30%
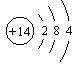
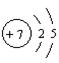 三、填空题
三、填空题
21、已知氮、硅原子结构示意图依次为:N 、Si 。
氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等。试写出氮化硅的化学式 。医学研究表明:偏硅酸有软化血管的作用,对心脏病、高血压有一定疗效。偏硅酸是二元酸,又是含氧酸,则偏硅酸的化学式为 。
22、2003年上半年“非典”肆虑时期,很多人通过服用维生素C泡腾片来给人体补充维生素C,增强机体抵抗力。将维生素C泡腾片放入一杯水中,药片会不断溶解,同时产生大量气泡,片刻后即成为一杯鲜甜的橙味饮品。维生素C泡腾片主要成分为维生素C;辅料为阿朴胡萝卜醛、橘味香精、橙味香精、维生素B2、糖精钠、碳酸氢钠、氯化钠、蔗糖、酒石酸晶体。
请回答以下问题:
(1)泡腾片放入水中后,产生的气泡是 气体,产生气泡的主要原因为 。
(2)泡腾片在投入到水中以前不产生气体的原因是
。
(3)维生素C泡腾片的贮藏条件是低温、避光、 。
23、某乡的村民普遍患有一奇怪的疾病,脱发、失明甚至死亡。经中国科学院地化所专家对该地区水源、植物进行分析,确定引起疾病的原因是附近矿山乱挖滥采,使水源中含铊(Tl)元素过高所致。
(1)为使当地民众摆脱困境,当务之急应采取的措施是 。
(2)高纯铊及其合金可作半导体材料,价格与黄金相当。写出分三步使硫酸亚铊转化为纯铊的化学方程式。
![]()
、
。
24、为防止大气污染,工业上产生的硫化氢(H2S)要经过处理,使其变成硫单质。富玛克斯法治理硫化氢的方法和步骤如下:
①用2%~3%的Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为NaHS;
②再加入一种RNO(液)(R表示一种有机基团)与生成的这种酸式盐的水溶液反应生成硫、碱和RNHOH;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
④RNHOH与空气中的氧发生反应又得到RNO。
(1)写出上述四步反应的化学方程式。
① ;
② ;
③ ;
④ 。
(2)富玛克斯法的总反应的化学方程式为: ,RNO在整个过程中起到 的作用。
25、某校化学课外活动小组研究外界条件对水中氧气含量的影响。他们利用仪器测得以下数据:
表1 某日的不同时间,长有水中植物的人工湖的水样
| 时 间 | 6:30 | 11:30 | 16:30 | 20:30 |
| 气温(℃) | 25 | 28 | 31 | 27 |
| 水中氧气的含量(mg/L) | 7.0 | 10.2 | 12.7 | 6.8 |
表2 某日同一时间,相距不远四个地点的水样
| 地点 | 造纸厂的排污口 | 菜市场的下水道 | 家中自来水 | 生长着植物的人工湖 |
| 水中氧气的含量(mg/L) | 0.2 | 1.2 | 5.0 | 11.8 |
请回答下列问题:
(1)在其它条件相同的情况下,随着温度的 (填“升高”或“降低”),氧气在水中的溶解度 (填“增大”或“减小”)
(2)分析表中的数据,可得出的结论是 。
(3)为了验证结论,进行了如右图所示的实验:
①实验要通入1种气体,这种气体是 ;
②试管内收集到的气体可用 来检验;
③欲达到该实验的目的,装置必须放在有 的环境中。
(4)若在家中饲养金鱼,提出给水增加氧气含量的两种方法:
① ;
② 。
26、某校化学兴趣小组对1瓶溶液进行分析,初步确定它是含有同种阴离子的M、N混合液,继续分析的步骤如下:
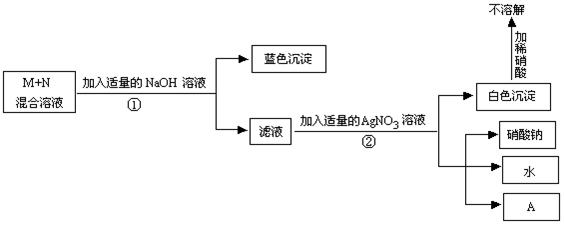 |
请根据过程及现象回答下列问题:
(1)若没有产物A,则M、N可能是 和 (写化学式);滤液中的溶质是 (写化学式);步骤①中发生反应的化学方程式是 ,步骤②中发生反应的化学方程式是 ,反应的基本类型是 。
(2)若有产物A,且它是一种复合钾肥,则M、N可能是 和 (写化学式);滤液中的溶质是 、 (写化学式)。
四、实验题
27、气体的制备是化学实验基本技能之一。现利用下列仪器进行实验,请问答:
(1)利用A装置,通过置换反应能制得的气体是 ,该反应的化学方程式是 ;其收集装置应选用 (填字母)
(2)利用A装置,通过复分解反应能制得的气体是 ,该反应的化学方程式是 。
(3)A装置在加药品前,必须进行气密性的检查,其操作是:
。
(4)将制得的氢气通入装有氧化铜粉末的E装置,加热,黑色粉末变红,说明氢气具有 性。
(5)由于氢气 ,可用作节日庆典气球的填充气。但由于氢气易燃易爆,所以在有氢气球的地方,最好放警示牌,请你写上一条警示语 。
28、某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
〖实验原理〗
![]()
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
〖实验装置〗
〖实验步骤〗
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端)
③按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口)
⑧计算。
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是
,干燥管C的作用是 ,E装置的作用是 ,步骤③中鼓气的目的是
;步骤⑥中鼓气的目的是
;本实验能否同时省略③、⑥两个步骤? ,原因是 。
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(ρ=1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
29、小明、小鹏和小芳三位同学在一起探究蜡烛燃烧,他们将短玻璃导管插入焰心,发现另一端也可以点燃。
(1)[提出问题] 导管里一定有可燃性气体,气体成分可能会是什么呢?
(2)[想 想] 小明认为:可能是蜡烛不完全燃烧时产生的CO。
小鹏认为:可能是蜡烛受热后产生的蒸气。
小芳认为:可能上述两种情况都有。
(3)[设计实验方案] 请你帮他们设计一个简单的实验方案,来判断哪一种分析是正确的。
(4)[现象与结论] 如果小明的猜想正确,现象应是
。
如果小鹏的猜想正确,现象应是
。
如果小芳的猜想正确,现象应是
。
(5)如果用![]() 表示蜡烛的主要成分,则其燃烧的化学方程式为:
表示蜡烛的主要成分,则其燃烧的化学方程式为:
。
五、计算题
30、蛋白质是机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应,生成氨基酸,蛋氨酸(化学式为![]() )就是其中的一种。请回答下列问题:
)就是其中的一种。请回答下列问题:
(1)蛋氨酸中各元素的质量比C:H:O:N:S= 。
(2)蛋氨酸中氮元素的质量分数为 。
(3)合格奶粉每100g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%,则每100g合格奶粉中氮元素的质量为 g;现测定某奶粉每100g中含有氮元素的质量为0.5g。则这种奶粉属于 (填“合格”或“不合格”)奶粉。
31、某管道煤气的主要成分是CO、H2和CH4等,其体积分数如下表:
| H2 | CO | CH4 | 其他 |
| ? | 15% | ? | 24% |
在充分燃烧时,H2、CO和CH4三种气体提供的能量占管道煤气提供总能量的85%。有一燃气热水器,某次使用时进水温度为12℃,出水温度为42℃,水流速度为5.0L/min(min代表分钟,下同),煤气的消耗量为60L/min,在使用过程中损失的能量占30%。已知这三种气体在12℃时的燃烧热值如下表:
| H2 | CO | CH4 |
| 12.2×106J/m3 | 12.1×106J/m3 | 38.0×106J/m3 |
水的比热容为4.18J/g℃。
求:管道煤气中H2和CH4的体积分数。
高一新生化学答题卷
一、选择题(每小题只有1个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
二、选择题(每小题有1个或2个选项符合题意)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三、填空题
21、 , 。
22、(1) , 。
(2) 。
(3) 。
23、(1) 。
(2) 、
24、(1)① ;
② ;
③ ;
④ 。
(2) , 。
25、(1) , 。
(2) 。
(3)① ;② ;③ 。
(4)① ;② 。
四、实验题
26、(1) , ; , ;
, 。
(2) , ; 、 。
27、(1) , ; 。
(2) , 。
(3)
。
(4) 。 (5) , 。
28、(1) , ,
。 ;
; ,
。
(2) , 。
29、(3)
。
(4) 。
。
。
(5) 。
五、计算题
30、(1) 。(2) 。(3) , 。
31、解:
高一新生化学答题卷
一、选择题(每小题只有1个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | B | D | B | D | C | B | D | C | A | C | B | D | B | A |
二、选择题(每小题有1个或2个选项符合题意)
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | C | C | AC | BC |
三、填空题
21、Si3N4,H2SiO3
22、(1)CO2 碳酸氢钠与酒石酸晶体溶于水后发生反应生成CO2 。
(2)投入到水中以前,泡腾片中的酒石酸晶体和碳酸氢钠以固体形成存在,不利于反应的进行。
(3)避免潮湿。
23、(1)停止乱挖滥采,改善水源
(2)![]() 、
、![]()
![]()
24、(1)①![]() ;
;
②![]() ;
;
③![]() ;
;
④![]()
(2)![]() ,催化剂
,催化剂
25、(1)升高,减小 (2)植物通过光合作用放出氧气
(3)①CO2 ; ②带火星的木条; ③阳光照射;
(4)①在水中适当放入水草; ②泵入空气
26、(1)![]()
![]() ;
; ![]() ;
;![]() ;
;
![]() ,复分解反应
,复分解反应
(2)![]()
![]() ;
;![]() 、
、![]()
四、实验题
27、(1)氢气,![]() ;C或D
;C或D
(2)CO2,![]()
(3)在导管外套上带止水夹的橡皮管,然后在分液漏斗中加入一定量的水至没过漏斗下端,静置。若液面静止不动,则装置不漏气,反之装置漏气
(4)还原 (5)密度比空气小,严禁烟火。
28、(1)除去鼓入的空气中的CO2,防止空气中的CO2和H2O进入B中影响实验结果,防止D中的水蒸气进入B中。用已除去二氧化碳的空气赶走体系中的二氧化碳;用已除去CO2的空气将反应产生的CO2全部赶入B中;不能,空气中的CO2含量与反应后体系中的CO2含量不同。
(2)43.2, 95.4%
29、(3)换一根较长的导管,并用湿毛巾包住导管,然后再在导管的另一端做点火试验。
(4)导管口同样能点燃,去掉毛巾,导管内壁看不到冷凝的固体。
导管口不能点燃,去掉毛巾,导管内壁可看到有冷凝的固体。
导管口能点燃,但失火面较小,去掉毛巾,导管内壁能看到冷凝的固体。
(5)![]()
五、计算题
30、(1)60:11:32:14:32 (2)9.4% (3)2.88;不合格
31、设氢气体积分数为X,则CH4体积分数为0.61-X,管道煤气实际提供的热能等于水升温所需热能。
60×[12.2×103X+0.15×12.1×103+(0.61-X)×38×103]÷85%×70%
=(42-12)×4.18×5000
X=0.477
即H2的体积分数为47.7%,CH4的体积分数为13.3%
答略