高一月考化学试题
化 学 试 题
一 选择题
1.下列化合物中,既存在离子键又存在极性键的是
A.H2O B. NH4Cl C. NaOH D. Na2O2
2.据报道,月球上有大量3He存在,以下关于3He的说法正确的是
A. 和4He化学性质几乎相同 B. 和4He物理性质几乎相同
C. 是4He的同位素 D. 是4He的同素异形体
3.下列物质中,既能与强酸又能与强碱反应的是
①Na2CO3 ②NaHCO3 ③Al2O3 ④Al(OH)3
A.①②③④ B.①②③ C.①②④ D.②③④
4.下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl3
5.下列关于原子的几种描述中,不正确的是
A. 18O与19F具有相同的中子数 B. 16O与17O具有相同的电子数
C. 12C与13C具有相同的质量数 D. 15N与14N具有相同的质子数
6.有人认为在元素周期表中,位于ⅠA族的氢元素也可以放在ⅦA族,下列物质能支持这种观点的是
A.HF B.NaH C.H3O+ D.H2O2
7. 2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
A.Ds原子的电子层数为7
B.Ds位于第ⅡA族
C.Ds原子的质量数为110
D.Ds为金属元素
8.设某元素的一种同位素原子的质子数为m,中子数为n,则下列论断正确的是
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若12C原子质量为Wg,此原子质量约为(m+n)W/12g
D.核内中子的总质量小于质子的总质量
9.下列说法中不正确的是
A.含有非极性键的分子一定是非极性分子 B.非极性分子中一定含有非极性键
C.以非极性键结合的双原子分子一定是非极性分子 D.非极性分子中电荷分布是对称的
10.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象,试判断下列哪组原子均可产生NMR现象
A. 18O 31P 119Sn B.元素周期表中VA族所有元素的原子
C. 27Al 19F 12C D.元素周期表中第1周期所有元素的原子
11.1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是
A.N5+共有34个核外电子 B.N5+中氮-氮原子间以共用电子对结合
C.化合物中As的化合价为+1价 D.该化合物为共价化合物
12.X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6,则由这三种元素组成的化合物的化学式不可能是
A. XYZ B. X4YZ4 C. X4Y2Z2 D. X2YZ3
13.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子物质的量是
A.n(A-N+8)/(A+16) mol B.n(A-N+10)/(A+16) mol
C.(A-N+2) mol D.n(A-N+6)/A mol
14.下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
15.电解普通水(H2O)与重水(D2O)的混合物,当电解一段时间后,两极共生成气体18.5g,其体积为33.6L(标态下)在所生成的气体中,重氢与普通氢的原子个数比为
A.1:2 B.1:3 C.2:3 D.2:5
16.下列几组最高价氧化物的水化物,酸性由强到弱顺序排列的是
A.H3PO4 HBrO4 H2SO4 H2CO3 B.H4SiO4 H2CO3 H2GeO3 H3AlO3
C.H2SO4 H2TeO4 HClO4 H2SeO4 D.HClO4 H2SeO4 H3AsO4 H3SbO4
17.已知反应KClO3+6HCl===KCl+3C12↑+3H2O,若用K35ClO3和H37C1作用,则下列说法正确的是
A.该反应中转移电子数为6 B.KCl中只含有35C1
C.KCl中既有35Cl,又含37C1 D.生成的氯气式量约为73.3
18.已知X、Y、Z、T四种非金属元素,X、Y在反应时各结合一个电子形成稳定结构所放出的能量是Y>X, 氢化物稳定性是HX>HT, 原子序数T>Z, 其稳定结构的离子核外电子数相等,而其离子半径是Z>T。四种元素的非金属性从强到弱排列顺序正确的是
A. X、Y、Z、T B. Y、X、T、Z
C. X、Y、T、Z D. Y、X、Z、T
二 填空题
19.GaAs是仅次于硅的一种新型半导体材料,其性能比硅更优越。Ga位于周期表中第ⅢA族,As位于周期表中第ⅤA族。
(1)Ga和As的最外层电子数分别是 。
(2)GaAs中Ga和As的化合价分别是 。
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为 。
20.A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子M层电子数为K层电子数的3倍。
(1)四种元素符号为A ,B ,C ,D ;
(2)A、B、C、D原子半径由大到小顺序为 ;
(3)四种元素中能形成X2Y型的化合物是 ,用电子式表示其形成过程:
;
四种元素中能形成XY2型的化合物是 ,用电子式表示其形成过程:
;
(4)由它们的同位素原子形成的XY型分子共有 种,其中质量数最小的一种分子可表示为 ;
(4)A、B、D原子形成的最高价氧化物的分子式分别为 、 、 .
21.如表是元素周期表的一部分。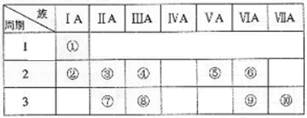
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱);
(2)表中元素⑤单质电子式为: ,形成该分子的粒子间相互作用为 (填离子键、极性键、非极性键,以下同);①⑥⑦形成化合物的电子式为 ,形成该物质的粒子间相互作用为 ;
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
,又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
22.某元素X的最高氧化物与水化合成三元酸,该酸分子中各元素原子个数比为X ∶H∶O=0.5∶1.5∶2,其中氢元素占分子总质量的3.06%,X原子中的中子数比质子数多1,则X为_____,位于第_____周期,第_____族,该元素氢化物的电子式为__________。
23.A、B、C、D、E五种元素,它们的原子序数由A至E逐渐增大。D 的氢化物的分子式为H2D;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1 mol的B 单质与H2完全反应需2.408×1023 个氢原子。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,回答下列问题:
(1) C位于元素周期表中第_____周期、第______族,其阳离子的结构示意图为______。
(2) A与D、A与E形成化合物的结构式分别为____________、________。
(3) C单质和B单质在加热条件下反应的化学方程式_________________反应中________为氧化剂;________为还原剂。
(4) 1.15 g的C单质溶于50 mL水中,所得溶液中溶质的质量分数为_____________,若溶液的体积仍为50mL,则溶质的物质的量浓度为 。
参考答案:
1B 2AC 3D 4C 5C 6B 7BC 8AC 9DC 10B 11CD 12A 13A 14D 15B 16D 17D 18B
19 3 5 +3 -3 SiC
20, (1)H、Cl、Mg、S(2)Mg S Cl H
(3)H2S、 MgCl2 (4)6 11H3517Cl (4)H2O、Cl2O7、SO3
21(1)HCl 弱 (2)![]() 极性键 Mg(OH)2 离子键 (3)Be(OH)2+2NaOH → Na2BeO2+2H2O;Li
极性键 Mg(OH)2 离子键 (3)Be(OH)2+2NaOH → Na2BeO2+2H2O;Li
22 P;第三周期,VA
23 (1)C O Na S Cl
(2)第三周期 ⅠA ![]()
(3)S=C=S CCl4
(4)2Na+O2=Na2O2 O2 Na (6)3.91%