化学高考题选(高一部分)
一、选择题:(每小题有一个或两个正确选项。)
1.以NA表示阿佛加德罗常数,下列说法中正确的是
A 53g碳酸钠中含NA个CO32- B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子 D 标准状况下11.2L臭氧中含NA个氧原子
2.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8g的NH+4离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为3NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
3.下列电子式中错误的是
A
Na+ B ![]() C
C ![]() D
D ![]()
4.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
5.X元素的阳离子和Y元素的阴离子具有相同的核外电子结构,下列叙述正确的是
A 原子序数X<Y B 原子半径X<Y
C 离子半径X>Y D 原子最外层电子数X<Y
6.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
A ![]() He
B
He
B ![]() He
C
He
C ![]() He
D
He
D ![]() He
He
7.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
8.ClO2一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A 1︰1 B 2︰1 C 1︰2 D 2︰3
9.某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A 10% B 15% C 20% D 25%
10.某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是
A 沉淀物的质量为5.6g B 沉淀物的质量为7.4g
C 饱和石灰水的质量大于98.2g D 饱和石灰水的质量小于98.2g
11.质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知 2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω1<ω2<2ω1
13.向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A NaCl Na2SO4 B NaCl NaBr Na2SO4
C NaCl Na2SO4 I2 D NaCl NaI Na2SO4
14.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH- RO4-+2F-+H2O
从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
15.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为
A 3.0mol B 1.5mol C 1.0mol D 0.75mol
16.浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A 1 B 2 C 3 D 4
17.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为
A 1︰2︰3 B 1︰6︰9 C 1︰3︰3 D 1︰3︰6
18.下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl5
19.既可以在强酸性条件下大量共存又能在强碱性条件下大量共存的离子组是
A Al3+ Na+ NO-3 Cl- B K+ Na+ Cl- NO3-
C K+ Na+ Cl- AlO2- D K+ NH+4 SO42- NO3-
20.在强酸溶液中,下列各组离子能够大量共存的是
A Mg2+、Ca2+、HCO3-、CI- B Na+、AlO2-、Cl-、SO42-
C K+、Fe2+、SO42-、Br- D Fe2+、Ca2+、Cl-、NO3-
21.下列除去杂质的方法正确的是
A 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
22.碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为
A 3.38g B 4.58g C 4.16g D 4.41g
23.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A 原子数 B 密度 C 质量 D 质子数
24.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是
A Br- B SO42- C H2SO3 D NH4+
25.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
A HCl和CO B HCl、H2和CO C CH4和NH3 D HCl、CO和CO2
26.能正确表示下列化学反应的离子方程式是
A 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B 金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C 硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D 碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
27.下列反应的离子方程式正确的是
A 铝片踉氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C 碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D 铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
28.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是
A NaOH B NH3·H2O C AgNO3 D BaCl2
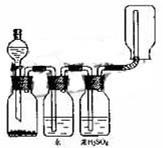 29.右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
29.右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A 锌和盐酸发生氢气
B 二氧化锰和浓盐酸生成氯气
C 碳酸钙和盐酸生成二氧化碳
D 氯化钠和浓硫酸生成氯化氢
30.要配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是 (填代号)。
A 称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B 称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C 称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D 用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
二、
31.周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式 。
32.A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
33.X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是 ,其中和产物的化学式是 。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是 。
三、实验题
34.(1)二氧化碳是共价化合物,它的电子式可表示为……………………。
(2)实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,产生的实验现象是……………………………………………………,相应的反应方程式为…………………………………………。
(3)在宇宙飞船和太空站上工作的宇航员,在密闭的工作舱内需要吸入氧气,呼出CO2,飞船内可以使用一种物质,它能吸收CO2,并产生氧气,该物质是………………………………………………,其反应方程式为…………………………………………………………。
35.实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法 | 实验过程中所发生反应的 化学方程式 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | |||
| 2 |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯
⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管
实验可能用到的试剂:
a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
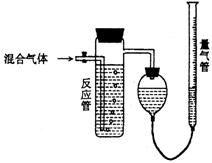 36.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
36.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四、计算题:
37.(8分)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00moL·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
答案:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | BC | C | C | D | B | C | B | D | D | C | C | AB | B | B |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| A | B | C | B | C | C | C | A | B | A | A | C | A | A | AD |
31.Na2O, K2S, MgF2, CaCl2
32.(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2)mA/MA=mB/MB+mC/MC(或MB<MA<MC;MC<MA<MB 以及其它合理答案)
(3)2种 Li2CO3 MgCO3 (4)MgCO3,BeCO3,Na2CO3 1.05
33.H2SO3,SO3,P2O5 Na3PO4、H2O 2P+5SO3=5SO2+P2O5
34.①略 ②产生白色沉淀(或白色混浊)。③Ca(OH)2+CO2=CaCO3↓+H2O ④Na2O2; ⑤2Na2O2+2CO2=2Na2CO3+O2↑(其他合理答案同样给分)
35.
| 实验方法 | 实验过程中所发生 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量 (用文字说明) |
| 1 | H2SO4+Zn→ZnSO4+H2↑ H2+CuO | ①②③⑦ | 实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量) 实验后Cu及硬质玻璃管的总质量 |
| 2 | H2SO4+CuO→CuSO4+H2O | ①⑤⑧⑨ | 过滤后剩余固体的质量 |
| 3 | 2Cu+O2 | ①④⑥⑦⑧ | 实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
(以上三种方法任选两种,其它合理的方法也给分)
36.(1)N2、O2的体积 (2)偏低 (3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)bceg或beg或ceg
37.混合物中Na2SO4的质量=![]() g·mol-1=1.42g
g·mol-1=1.42g
设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量=![]() =0.0900mol 与Na2CO3、NaHCO3反应的盐酸的物质的量为
=0.0900mol 与Na2CO3、NaHCO3反应的盐酸的物质的量为
0.250L×1.00mol·L-1-0.500L×0.100mol·L-1×2+0.0100L×1.00 mol·L-1=0.160mol
![]()
解得:x=0.0700mol y=0.0200mol
Na2CO3质量=0.0700mol×106g·mol-1=7.42g
NaHCO3质量=0.0200mol×84g·mol-1=1.68g