![]()
|
|
学科: 化学 |
| 教学内容:碱金属元素 |
【基础知识精讲】
一、碱金属元素的“三性”(括号内为特殊性)
1.相似性
(1)原子结构:最外层电子数都是1个,次外层为8个(Li为2个)的稳定结构.
(2)单质的物理性质:都有银白色的金属光泽(除铯略带金色以外),质软,密度小,熔点低,有强的导热、导电性能.
(3)单质的化学性质:与钠相似,都能与金属、与氧气、与水、与稀酸溶液等反应,且生成物都是含R+(R为碱金属)的离子化合物.
(4)它们最高价的氢氧化物(ROH)均是强碱.
2.递变性(差异性)
(1)原子结构:随着Li、Na、K、Rb、Cs核电荷数递增,核外电子层数增多,原子半径逐渐增大.
(2)单质的物理性质:随着Li、Na、K、Rb、Cs核电荷数递增,碱金属熔、沸点逐渐降低(与卤族、氧族单质相反),密度逐渐增大(Li、Na、K的密度<1g/cm3,Rb、Cs的密度>1g/cm3).
(3)单质的化学性质:随着Li、Na、K、Rb、Cs核电荷数递增,核对电子引力减弱,失电子能力增强,因此金属性增强.例如,与氧气反应时,Li:常温或燃烧生成Li2O;Na:常温生成Na2O,燃烧生成Na2O2;K:常温生成K2O2,燃烧生成KO2(超氧化钾).
(4)ROH碱性随R核电荷数递增而增强.
二、焰色反应
1.焰色反应是指某些金属或它们的化合物在灼烧时火焰呈特殊的焰色.
2.常见金属,及其化合物焰色:
Na:黄色 K:紫色(透过蓝色钴玻璃) Cu:绿色 Ca:砖红色 Ba:黄绿 Li:紫红色
3.操作:取洁净铂丝(或无锈铁丝或镍、铬、钨丝)在盐酸中浸洗后灼烧至无色,然后蘸取待测物灼烧.
4.焰色反应不属于化学法检验.
【重点难点解析】
一、碱金属与氧生成的化合物:
氧化物中存在O2-,如:Na2O、K2O、Li2O、…属碱性氧化物,与酸反应,只能生成盐和水,如:
Na2O+2HCl = 2NaCl+H2O
而过氧化物中存在O22-过氧离子,其中氧价态为-1价,如Na2O2、CaO2、…与酸反应生成盐和水,同时还有O2放出,如:
2Na2O2+4HCl = 4NaCl+2H2O+O2↑
还有超氧化物,如:KO2,含有O2-,其中氧价态为-![]() 价,当然可能有更复杂的化合物.
价,当然可能有更复杂的化合物.
应注意:过氧化物、超氧化物都不属碱性氧化物.
二、碱金属元素的相似性、差异性和递变性:
1.相似性
(1)原子结构.最外层都只有1个电子,并且都容易失去这个电子而形成+1价阳离子.表现出强还原性.
(2)单质的化学性质.
①都能与O2、水、稀酸反应,反应中均为还原剂.
②它们的最高价氧化物的水化物都是强碱.
2.差异性、递变性
(1)原子结构.从Li→Cs随着核电荷数的递增,电子层数增加,原子半径增大.
(2)化学性质.
①随着原子半径的逐渐增大,原子核对最外层电子的引力逐渐减弱,使得原子失电子的能力逐渐增强,则金属的还原性也逐渐增强.
②随着核电荷数的增加,碱金属元素的最高价氧化物的水化物的碱性逐渐增强.
三、用讨论法解化学元素计算题的一般思路:
有一类化学计算题,由于某一条件的不确定,结果可能是两个或两个以上,也可能在某个范围内取值,这类题就需要用讨论的方法求解.近几年高考中出现的涉及讨论的试题主要有四种类型:①讨论反应发生的程度;②讨论反应物是否过量;③讨论反应物或生成物的组成范围;④讨论不定方程的解.
前三种类型的讨论题一般思路是:①首先利用有关反应方程式(或加工变形的关系式)确定两种反应物恰好完全作用时,各反应物和生成物的具体的量的关系;②然后再按某一反应物的量不足或过量分别讨论;③最后将①②联系起来找出各种情况下对应的答案或取值范围.
对不定方程的讨论,需充分利用题目中给出的条件,有选择范围地讨论.
【难题巧解点拨】
例1 某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8g样品加入足量水中,样品全部溶解.再加入过量的CaCl2溶液,得到9g沉淀.对样品所含杂质的正确判断是( )
A.肯定有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能含有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
解析 将13.8g样品加入足量的水,样品全溶解则样品中一定无Ba(NO3)2(因能与K2CO3生成沉淀).下面用极值法分析:如13.8g是纯的K2CO3,则生成CaCO3沉淀应为10g,而现在得沉淀9g,则混进的杂质或不与CaCl2生成沉淀,或13.8g杂质与CaCl2作用生成的沉淀小于9g.杂质中KNO3不与CaCl2生成沉淀,符合题意.而13.8gNa2CO3与CaCl2混合生成沉淀为![]() ×100>9g不合理.所以选项A正确.但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8g样品与CaCl2反应后只生成9g沉淀,故B正确.选项B很容易漏掉.故选A、B.
×100>9g不合理.所以选项A正确.但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8g样品与CaCl2反应后只生成9g沉淀,故B正确.选项B很容易漏掉.故选A、B.
评析 此题考查学生思维的严密性.
例2 18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分的反应后排出气体,冷却,称得剩余固体质量为16.6g.试计算原混合物中NaOH的百分含量.
解析 解法Ⅰ 混合物加热时的化学方程式为:
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2NaOH+CO2 = Na2CO3+H2O
综合为:
NaHCO3+NaOH![]() Na2CO3+H2O
Na2CO3+H2O
84 40
124 106
假设18.4g混合物恰好按84∶40比例混合,设加热后剩余固体为x,则
124∶106=18.4g∶x x=15.7g而实际16.6g,可见NaOH过量.设NaHCO3质量为y,NaOH为18.4g-y
NaOH+NaHCO3=Na2CO3+H2O
84 18
y 18.4g-16.6g=1.8g
y=8.4g
∴NaOH%=![]() ×100%=54.3%
×100%=54.3%
解法Ⅱ 判断混合物中哪种物质过量还可以根据差值法,因为NaOH受热时不分解,所以:
NaOH+NaHCO3![]() Na2CO3+H2O
Na2CO3+H2O
40 84
124 18
18.4g x
x=2.67g>1.8g,说明NaOH过量.
解法Ⅲ 设混合物由等摩尔比组成,并设形成1.8g(18.4g-16.6g)差量时消耗混合物的质量为m,则124∶18=m∶1.8g m=12.4g 因为原混合物为18.4g形成1.8g差值只需12.4g,所以余下18.4g-12.4g=6g,这6g不是NaHCO3而是不分解的NaOH,说明NaOH过量.以下解法同上.
评析 许多计算题并不明显给出已知条件,初审时感到条件不足,这时就要仔细分析,挖掘隐含条件.本题的关键是要判断NaOH和NaHCO3在反应时哪一种过量.而题目的条件只是反应前后的固体混合物的质量变化,NaOH与NaHCO3按不同比例混合时,引起的质量减小也不同,再与已知条件相比较,即可判断是哪种物质过量.
【典型热点考题】
例1 关于锂的结构和性质的判断,错误的是( )
(1)与水反应比钠剧烈
(2)它的原子半径比钠小
(3)它的氧化物暴露于空气易吸收二氧化碳
(4)它的阳离子最外层电子数和钠的相同
(5)它是还原剂
A.只有(1) B.(3)和(5) C.(2)和(3) D.(1)和(4)
解析:该题为碱金属元素性质的判断题,解此题的关键是注意对碱金属元素的相似性、差异性和递变性的理解和掌握.(1)钠比锂的金属性强,所以锂与水反应不如钠剧烈,此项说法错误.(2)锂原子的电子层为2层,钠原子有3个电子层,所以前者比后者原子半径小.此项正确.(3)氧化锂与氧化钠相似,也是碱性氧化物,易吸收酸性氧化物二氧化碳变为碳酸盐.(4)锂离子Li+最外层只有2个电子,而钠离子Na+最外层有8个电子,此项说法错误.(5)锂也是活泼金属,它在反应中只能作还原剂.故答案为D.
例2 下列关于钾、钠、铷、铯的叙述中不正确的是( )
A.其氢氧化物中碱性最强的是CsOH
B.氧化能力最强的是钠原子
C.原子半径随核电荷数的增大而增大
D.单质的密度均小于1g/cm3
解析:在Na、K、Rb、Cs四种碱金属中,Cs的金属性最强,所以CsOH的碱性最强,A选项正确;钠原子只能失去电子,不能得到电子,即钠原子没有氧化性,B选项错误;核电荷数越大,电子层数越多,原子半径越大,C选项正确;从Na→K→Rb→Cs,碱金属的密度逐渐增大,K、Na的密度小于1g·cm-3,但Rb、Cs的密度大于1g·cm-3,D选项错误.
答案:B、D.
例3 某物质燃烧时,焰色为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物 B.该物质中一定含有钾元素
C.该物质一定是金属钠 D.该物质中一定含有钠元素
解析:所谓焰色就是指一些发光物质,当加热提供其一定的能量时,自身便可发出各种颜色的光.由此看出它的能量转换是提供的能量直接转变成光能.这一点与白炽灯的工作能量转换有着明显的区别,正因为如此,发光物质的研究才是当今的活跃科技领域之一.那么发光物质的发光是由原子产生的,还是由离子产生的呢?请注意下列事实:①路边的照明灯发出光多为黄色,原因是路灯里装入的是纯净的金属钠,当通电后钠汽化,钠原子接受电能并将其转化为光能,从而产生黄光.用这种路灯有两大好处:一是省电,二是光的亮度是同功率白炽灯的几倍至几十倍.②我国每逢重大的庆祝活动或重大的节日,有放焰火的习惯,若放出黄色焰火,则制造焰火的原料必有NaCl,因为Na+产生的焰色是黄色的.由此可以看出:发光物质的颜色既不能断言是离子的,也不能确认是原子的,所以说焰色反应是元素的行为.
答案:D.
例4 将含Na2CO310.6g的Na2CO3溶液100mL逐滴滴加到100g4.56%的盐酸中与将100g4.56%的盐酸逐滴滴加到含Na2CO310.6g的Na2CO3溶液100mL中,两者所产生的气体的质量比是( )
A.1∶1 B.2∶5 C.5∶2 D.2∶1
解析:将Na2CO3加到盐酸中(相对而言,过程中酸过量)与将盐酸加到Na2CO3中(相对而言,过程中Na2CO3过量),两者发生的反应是有区别的.
第一种情况:Na2CO3+2HCl=2NaCl+CO2↑+H2O
第二种情况:HCl+Na2CO3=NaHCO3+NaCl
HCl+NaHCO3=NaCl+H2O+CO2↑
现Na2CO3质量为10.6g,HCl质量为4.56g,在第一种情况下,应按HCl的质量来算产生的CO2的质量.设产生CO2的质量为x:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
4.56g x
x=2.75g
在第二种情况下,应分步计算,设生成NaHCO3所消耗HCl的质量为Y,生成NaHCO3的质量为W,最后产生的CO2的质量为Z.
HCl + Na2CO3= NaHCO3+NaCl
36.5 106 84
Y 10.6g W
y=3.65g W=8.4g
这时,剩余HCl的质量=4.56g-3.65g=0.91g.
显然,在接下来的反应中,应按HCl的质量来算产生的CO2的质量.
HCl + NaHCO3=NaCl+ CO2↑+H2O
36.5 44
0.91g W
W=![]() =1.1g
=1.1g
所以,两种情况下产生的CO2的质量比是2.75g∶1.1g=5∶2.
答案:C.
例5 由某碱金属(R)及其氧化物(R2O)组成混合物4.0g与水充分反应后,蒸发反应后的溶液,得到5.0g无水晶体.试通过计算确定该金属元素的名称.
解析:本题若用常规方法求解,非常麻烦.若用极端假设法,则可事半功倍.用极端假设法解题的一般方法是:以问题的两个极端去提出假设,求出极值(最大值或最小值)后,确定一个取值范围,利用这个取值范围进行推理、判断,使问题得到解决.可见,本题虽是一道化学计算题,但其中除了包含着的化学原理之外,还隐含着数学理念.本题的化学原理比较简单,不过是两个反应式,即:
2R+2H2O = 2ROH+H2↑
R2O+H2O = 2ROH
显然,无论是R,还是R2O与水反应的结果都必然最终导致固体的质量增加.假定该混合物是由单一成分组成的纯净物,可计算出该原子的相对原子质量的取值范围.
解答:设碱金属R的相对原子质量为x,则R2O的相对分子质量为2x+16.
若全为金属,则有关系式: 若全为氧化物,则有关系式:
R → ROH R2O → 2ROH
x x+17 2x+16 2(x+17)
4.0g 5.0g 4.0g 5.0g
![]() =
=![]()
![]() =
=![]()
x=68 x=28
因为混合物为金属和氧化物组成,故金属的相对原子质量应介于28~68之间,在此区间内的碱金属只有钾.
故,该碱金属元素为钾.
例6 现有A、B、C、D四种化合物,透过蓝色钴玻璃其焰色反应均为紫色,A、B、C和盐酸发生反应后,均得到D;将固体C加热可得到A;若在A的溶液中通入一种无色无味气体,可制得C,若B与C的溶液混合可制得A;推断:A为 ;B为 ;C为 ;D为 .写出有关反应的化学方程式: .
解析:解该题的突破口在A、B、C均可与盐酸发生反应,证明A、B、C可能是KOH或K的弱酸盐,而下一步展开,C加热可分解,进一步证明C是KHCO3,A溶液中通入无色无味气体得C,进一步证明C是KHCO3,而A为K2CO3.这样可知D为KCl.
因此解此类推断题重要的是找准突破口,突破口一找到,其他问题则会迎刃而解.
另外,本题第一已知条件:“其焰色反应均为紫色”也很重要,据此,我们首先可断定这四种化合物含有钾元素.
答案:A.K2CO3;B.KOH;C.KHCO3;D.KCl;化学方程式为:2KHCO3![]() K2CO3+CO2↑+H2O;K2CO3+CO2+H2O
= 2KHCO3;KOH+KHCO3
= K2CO3+H2O
K2CO3+CO2↑+H2O;K2CO3+CO2+H2O
= 2KHCO3;KOH+KHCO3
= K2CO3+H2O

【同步达纲练习】
一、选择题
1.跟水反应最剧烈的碱金属是( )
A.Li B.Na C.K D.Rb
2.下列比较不正确的是( )
A.熔点:Li>Na>K B.碱性:LiOH<NaOH<KOH
C.还原性:K>Na>Li D.氧化性:Cs+>Rb+>K+
3.下列物质在自然界中存在的有( )
A.KNO3 B.KOH C.K2O2 D.K
4.下列化合物中,阴阳离子半径比最大的是( )
A.NaF B.LiF C.LiI D.CsI
5.焰色反应是指( )
A.可燃物在燃烧时所显示的火焰颜色
B.所有元素在灼烧时都有焰色反应
C.多种金属或它们的化合物灼烧时所显示的火焰颜色
D.焰色反应是一种化学变化
6.物质灼烧时,火焰呈紫色的一定含有( )
A.钾原子 B.钾离子 C.钾元素 D.钾的化合物
7.把一小块金属钾投入硫酸铜溶液中,生成物有( )
A.Cu和K2SO4 B.Cu、K2SO4和H2
C.K2SO4、Cu(OH)2和H2 D.Cu、KOH和H2
8.下列物质中,既能与氢氧化钠溶液反应,又能与盐酸反应的是( )
A.Na2CO3 B.(NH4)2CO3 C.NaHCO3 D.K2SO4
9.下列物质加入到水中无气体放出的是( )
A.金属钾 B.氧化钠 C.纯碱 D.过氧化钾
10.钾和钠的性质相似,下列说法中能较好地解释这个事实的是( )
A.最外层电子数相同 B.都是金属元素
C.原子半径相差不大 D.最高化合价相同
二、填空题
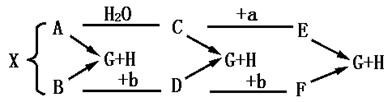
11.某种金属单质X可能发生如下图所示的转化关系,A、B、C、D、E、F、G均为该金属的化合物,G的焰色反应呈黄色火焰.A、B、C、D、E、F与盐酸反应后的产物均有G和H.a、b是都能使澄清石灰水变浑浊的气体,B是具有漂白作用的固体物质.根据关系图可知(写化学式):A B C D E
F G H X a b
12.碱金属(除钫外)中,原子半径最大的是 ,密度比水大的是 ,熔、沸点最高的是 ,单质的金属活动性最强的是 ,与水反应最强烈的是 .
13.通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为 ;不能用NaOH溶液的原因是 (用离子方程式表示);不能用Na2CO3溶液的原因是 (用离子方程式表示).
三、计算题
14.将70gNa2O2和Na2O的混合物跟98水充分反应后,所得NaOH溶液的质量分数为50%,计算原混合物中Na2O2和Na2O质量各为多少克?
【素质优化训练】
1.下列关于铯及其化合物的说法,不正确的是( )
A.氢氧化铯是一种强碱 B.铯与水或酸反应剧烈,都能放出H2
C.碳酸铯加热可生成氧化铯和CO2 D.铯与氧反应的产物很复杂.
2.今有10.8g某碱金属R及其氧化物R2O组成的混合物,加足量水溶解后加热蒸干并干燥得固体16g,可确定该金属R是( )
A.Li B.Na C.K D.Rb
3.氢化钠(NaH)是一种白色的离子晶体,其中钠为+1价,NaH与水反应放出H2下列叙述正确的是( )
A.NaH在水中显酸性 B.NaH中氢离子的电子层排布与氦原子相同
C.NaH氢离子可被还原成H2 D.NaH与水反应时水作氧化剂
4.把7.4g小苏打和Na2CO3·10H2O组成溶于水制成100mL溶液,其中C(Na+)=0.6mol·L-1.若将等质量的该混合物加热至恒重,则该混合物的质量减小了( )
A.2.12g B.3.18g C.4.22g D.5.28g
二、填空
5.有A、B、C、D四种物质的溶液,在进行焰色反应时,火焰均呈黄色.它们之间可发生如下转化,则这四种物质分别是:
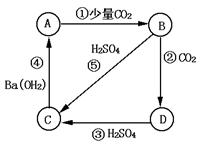
A B C D
有关离子方程式:
①
②
③
④
⑤
6.有一包固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、BaCl2、K2CO3和K2SO4中的一种或几种,现进行以下实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)将滤出的沉淀中加入稀硝酸后有部分沉淀溶解,并有无色气体.
(3)取滤液做焰色反应、火色呈黄色、隔着蓝色钴玻璃,不见紫色,由上述实验现象判断:混合物中一定含有 ;一定不含有 ,不能肯定是否含有 .
【生活实际运用】
1.国庆焰火晚会施放的焰火五颜六色,对此叙述不正确的是( )
A.五颜六色是火药本身燃烧的颜色
B.颜色是火药内掺入的金属离子焰色反应引起的
C.金属的焰色反应是物理变化
D.火药内掺入的是金属单质
2.氯化钠在人体中维持水、电解质平衡,成人每天摄入食盐的最佳量为( )
A.1~2g B.5~10g C.15~20g D.0.5~1g
3.为了使鱼苗顺利运输,必须满足三个条件:①需要保持适量的氧气;②使鱼苗呼出的CO2及时排出;③防止细菌大量繁殖.已知下述四种物质加入水中都可起到供氧灭菌的作用,CaO2微溶于水,生成氧气和Ca(OH)2.在长距离储运鱼苗的水中,最好加入( )
A.Na2O2 B.氯水 C.CaO2 D.H2O2
4.Na2O2可以做潜艇上的补氧剂,该反应中 是氧化剂, 是还原剂.若潜艇上有50人,每人每分钟消耗0.8LO2(密度为1.43g/L),则一天需消耗 gNa2O2.
若用KO2(超氧化钾)代替Na2O2做补氧剂,请回答下列问题:
(1)KO2与CO2反应的化学方程式是 .
(2)等质量的KO2和Na2O2分别与足量的CO2反应,生成O2的质量比是 .
(3)等质量的CO2分别与足量的KO2和Na2O2反应,生成O2的质量比是 .
对比KO2和Na2O2,更适合的补氧剂是 ,理由是 .
5.用面粉发面时,有时直接用小苏打掺入面中,掌握好用量也能使馒头“发”起来,解释原因并写出反应方程式.

参考答案:
【同步达纲练习】
一、1.D 2.AD 3.A 4.C 5.C 6.C 7.C 8.BC 9.BC 10.A
二、11.Na2O;Na2O2;NaOH;Na2CO3;Na2SO3;NaHCO3、NaCl;H2O;Na;SO2;CO2 12.铯;铷和铯;锂;铯;铯 13.H++HCO3-=CO2↑+H2O;CO2+2OH-=CO32-+H2O CO32-+CO2+H2O=2HCO3-
三、14.m(Na2O2)=39g m(Na2O)=31g
【素质优化训练】
一、1.C 2.B 3.BD 4.C
二、5.A:NaOH B:Na2CO3 C:NaHCO3 D:Na2SO4
①2OH-+CO2=CO32-+H2O ②CO32-+H2O+CO2=2HCO3- ③HCO3-+H+=H2O+CO2↑ ④Ba2++SO42-=BaSO4↓
6.一定含有Na2CO3、Na2SO4、BaCl2;一定不含有CuCl2、K2CO3、K2SO4;可能含有NaCl.
CO32-+CO2+H2O=2HCO3-
