离子反应 离子反应方程式练习题
1、下列各化学反应的离子方程式中,有错误的是
A、氢氧化铝跟盐酸反应
Al(OH)3+3H+=Al3++3H2O
B、浓三氯化铁溶液跟铜反应
Fe3++Cu=Fe2++Cu2+
C、碘化钾溶液跟适量溴水反应
2I-+Br=I2+2Br-
D、甲酸跟氢氧化钠溶液反应
HCOOH+OH-=HCOO-+H2O
E、金属钠跟水反应
Na+2H2O=Na++2OH-+H2↑
2、下列反应的离子方程式不正确的是
A、醋酸加入氨水
CH3COOH+NH3·H2O
![]() CH3COO-+NH4++H2O
CH3COO-+NH4++H2O
B、铜片插入硝酸银溶液
Cu+Ag+=Cu2++Ag
C、碳酸钙加入醋酸
CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
D、硫氰化钾溶液加入三氯化铁溶液
Fe3++SCN-=[Fe(SCN)]2+
3、在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A、NH4+,Al3+,SO42-,NO3-
B、K+,Na+,AlO2-,NO3-
C、K+,NH4+,MnO4-,SO42-
D、Na+,K+,NO3-,HSO3-
4、下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是
A、K+、MnO4-、Cl-、SO42-
B、Na+、AlO2-、NO3-、CO32-
C、Na+、H+、NO3-、SO42-
D、Na+、SO42-、S2-、Cl-
5、下列各组离子在水溶液中能大量共存的是
A、K+、HCO3-、CO32-、Br-
B、CO32-、HCO3-、OH-、K+
C、Fe3+、Cu2+、NO3-、SO42-
D、H+、Cl-、Na+、SO32-
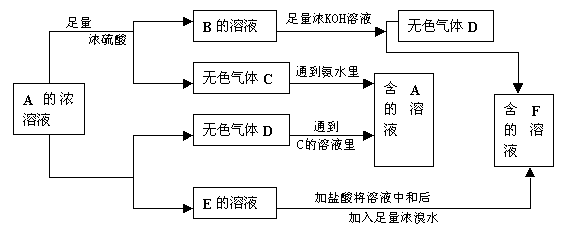
6、从某物质A的水溶液出发有下图所示的一系列变化:
请回答:(1)物质的分子式:A_____________,B____________,C________,D___________,E______________,F_____________。
(2)写出E→F的离子方程式_____ ________。
(3)鉴定物质F的方法________ ______。
参考答案
1、解析:B电荷不守恒;E得失电子总数不相等。
答案:BE
2、解析:B电荷不守恒;C碳酸钙难溶于水应保留化学式。
答案:BC
3、解析:解答离子共存问题,主要应从如下几个方面入手迅速确定正确选项:(1)各组中离子有无直接发生离子反应的离子;(2)组内有无能发生氧化还原反应的离子;(3)组内有无能发生双水解的离子。同时还应注意题中所给的限制条件,如“酸性”或“碱性”溶液中,“无色溶液”中等。
B项中AlO2-在强酸性条件下不能存在,否则发生反应H++AlO2-+H2O=Al(OH)3↓;C项中MnO4-为紫色;D项中HSO3-在强酸性条件生成H2SO3并且被HNO3氧化成H2SO4
答案:A
4、解析:A中MnO4-显紫色;C中H+在碱性溶液中发生反应H++OH-=H2O
答案:BD
5、解析:B中HCO3-与OH-不能共存:HCO3-+OH-=H2O+CO32-;D中2H++SO32-=H2O+SO2↑
答案:AC
6、解析:这个图示看起来复杂,实际上若能迅速找到突破点,问题并不难解出。A溶液既能与浓硫酸反应,又能与氢氧化钾反应,说明它的阴离子和阳离子含有弱电解质的离子或能被氧化的离子。反应中都有气体产生,说明阴、阳离子都具挥发生,无色气体C与氨水反应,D又与C的溶液反应,可见D为NH3,C为CO32-、HCO3-或SO32-、HSO3-等,E与溴水反应,∴排除CO32-,E是K2SO3,F即为K2SO4。这样其它问题均可得出答案。
答案:(1)A:NH4HSO3或(NH4)2SO3;
B:NH4HSO4或(NH4)2SO4;C:SO2;D:NH3;E:K2SO3;F:K2SO4
(2)SO32-+Br2+H2O=SO42-+2Br-+2H+
(3)通过焰色反应鉴定K+(隔钴玻璃火焰呈浅紫色);取少量F的溶液加入氯化钡和盐酸的溶液,若产生白色沉淀,证明SO42-的存在。